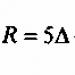Classe: 7
Présentation de la leçon






















 Retour avant
Retour avant
Attention! Les aperçus des diapositives sont fournis à titre informatif uniquement et peuvent ne pas représenter toutes les fonctionnalités de la présentation. Si ce travail vous intéresse, veuillez télécharger la version complète.
Classe: 7e année.
Âge de l'étudiant : de 25 ans à 30 ans
Le but de la leçon : Introduire dans le monde de la structure de la matière.
Objectifs de la leçon:
Éducatif:
- Présenter aux élèves la structure de la matière.
- Introduire de nouveaux concepts : « molécule », « atome ».
- Initier les élèves aux propriétés des molécules.
- Montrez la nécessité d'étudier ce sujet et d'utiliser les connaissances sur le sujet dans la pratique.
Du développement:
- Développer l’intérêt des élèves pour l’apprentissage,
- Élargissez leurs horizons, leur mémoire, leur imagination.
- Développer la capacité de penser, de tirer des conclusions, de comparer, de réfléchir,
- Appliquer les connaissances acquises à une nouvelle situation.
- Formation de la compétence informationnelle.
Éducatif:
- Formation d'une image scientifique du monde et d'une vision du monde chez les étudiants,
- Continuez à développer une motivation positive pour l’apprentissage.
- Compétences en communication, discipline.
- Susciter l’intérêt pour l’étude de la physique.
Type de cours : une leçon d'apprentissage de nouveau matériel à l'aide d'une présentation.
Équipement: ordinateur, projecteur multimédia, présentation « Structure de la matière. Molécule", manuel "Physique -7" de A.V. Peryshkin, trois béchers, gouache bleue, un récipient avec de l'eau.
Pendant les cours
1. Organisation. moment.
Répétition du matériel précédemment étudié :
Test n°2 sur le thème : « Phénomènes physiques » - maîtrise de soi.
1. Lequel des éléments suivants est un corps physique ?
8. ouragan.
2. Lequel des éléments suivants est une substance ?
4. crayon
5. corde
8. verre.
3. Quels mots désignent des grandeurs physiques ?
2. vitesse
4. règle.
4. Quels phénomènes sont considérés comme mécaniques ?
1. vol d'oiseau
2. rayonnement solaire
3. gouttes de pluie qui tombent
5. Quels phénomènes sont considérés comme physiques ?
2. feuilles jaunies
3. des gouttes de pluie qui tombent.
| Activités de l'enseignant en classe | Activité étudiante |
| 2. Répétition du matériel précédemment étudié : 1). Travailler avec la pâte. 2). Maîtrise de soi |
1. Les élèves travaillent sur le test. 2. Après l'avoir complété, vérifiez les réponses avec les miennes (elles sont inscrites au tableau). 3. Se donner des notes (je les transférerai plus tard dans le journal) Bonnes réponses - Note « 5 » – 5 “4” ---------4 “3” ----------3. |
| 3. Présentation du nouveau matériel : (l'histoire de l'enseignant est accompagnée d'une présentation et d'une conversation avec les élèves) 1). Vous et moi savons qu'en physique, les corps qui nous entourent sont la pierre, la Lune, les maisons, les tables... Quel est le nom de? Diapositive numéro 2. 2). De quoi sont faits tous les corps physiques ? Diapositive numéro 3. 3). De quoi sont constituées toutes les substances ? (Je développe l’intérêt des étudiants, les motive vers un nouveau sujet) Diapositive numéro 4. |
Répondez à la question. Répondez à la question. Les réponses des étudiants varient |
| 4). Diapositive numéro 5. Écrivez le sujet de la leçon : « Structure de la matière. Molécules." De quoi allons-nous parler dans notre leçon d’aujourd’hui ? |
Les élèves notent le sujet de la leçon dans leurs cahiers. Les réponses des élèves varient, mais je les ramène au but de la leçon. |
| 5). Lorsqu'on leur a demandé de quoi sont faits tous les corps, les scientifiques y ont pensé dans l'Antiquité, car il était nécessaire de se lancer dans la construction : construire des temples, des pyramides, développer la navigation et cultiver la terre. Et pour cela, il fallait savoir comment les corps et les substances se comportent dans certaines conditions. Des informations étaient nécessaires sur les propriétés de divers matériaux, etc. Les scientifiques de l’époque posaient la question : « De quoi sont faits tous les corps qui nous entourent ? Selon vous, quelle est l’importance de cette question ? Sont-ils solides ou sont-ils construits à partir de très petites particules invisibles, mais dont ils ont deviné l'existence, sur la base d'observations. Diapositive n° 6, n° 7, n° 8. (sur les scientifiques et leurs déclarations sur la structure des substances). |
Les élèves écoutent le professeur. Les réponses varient selon les étudiants. Écrivez dans un cahier. Il y a 2500 ans Démocrite : « Toutes les substances sont constituées de particules. » |
| 6). Diapositive numéro 9. Considérons une expérience avec vous : un petit grain de gouache bleue a été dissous dans un récipient contenant de l'eau. Après un certain temps, l’eau deviendra bleue. Versons de l'eau colorée dans un autre récipient et ajoutons-y de l'eau propre. La solution dans le deuxième récipient sera moins colorée que dans le premier. Ensuite, à partir du deuxième récipient, nous versons à nouveau la solution dans le troisième récipient et complétons à nouveau avec de l'eau propre. L'eau de ce récipient sera encore moins colorée que celle du deuxième récipient. Question : Quelle conclusion peut-on tirer de cette expérience ? Conclusion : un petit grain de gouache a été dissous dans l'eau et seule une infime partie est entrée dans le troisième récipient, on peut alors supposer que la substance est constituée de très petites particules Question : Quelle hypothèse cette expérience confirme-t-elle ? |
Les élèves essaient de donner une réponse, c'est-à-dire tirer une conclusion. Les élèves donnent une réponse. Prenez note dans un cahier. |
| 7). Diapositive numéro 10. Nous répétons encore une fois : 1. De quoi sont faits les corps physiques ? 2. De quoi est constituée la substance ? 3. De quoi sont constituées les particules de matière ? |
|
| 8). Et une particule de matière est constituée de très petites particules. Cela a été prouvé par la science moderne. Cette petite particule était appelée « molécule ». Question : Qu’est-ce qu’une « molécule » ? Diapositive numéro 11. |
Entrée « Molécule » Notation : une molécule d'une substance est la plus petite particule d'une substance donnée. |
| 9). Imaginons la taille de la molécule. Diapositive numéro 12. En raison de leur petite taille, les molécules sont invisibles à l’œil nu ou au microscope ordinaire. Mais avec l'aide d'un appareil spécial - un microscope électronique, Diapositive numéro 13, Vous pouvez examiner et même photographier des molécules plus grosses. F-7, page 19, Fig. 20 photo - disposition des molécules de protéines. On calcule que dans un volume de 1 cm 3 d'air il y a environ 27 10 18 molécules. |
Entrée du carnet : Comparaison: molécule – pomme – Terre. Enregistrement : microscope électronique. Travailler avec le manuel. Écrivez dans un cahier. |
| dix). La molécule est constituée de particules encore plus petites - des atomes. | |
| Diapositive numéro 14. Le mot « atome » signifie indivisible. Vous étudierez la structure de l'atome dans les cours de chimie en 8e et dans les cours de physique en 9e. Diapositive numéro 15. Les atomes sont généralement désignés par des symboles : "O" atome d'oxygène « H » est un atome d'hydrogène. (Voir le tableau de D.I. Mendeleev) La plus petite particule d'eau est une molécule d'eau. Il est constitué de trois atomes : deux atomes d’hydrogène et un atome d’oxygène. |
L'atome est « indivisible ». Écrivez dans un cahier. |
| Diapositive numéro 16. (Vous en apprendrez davantage dans les cours de chimie en 8e année). onze). Au XVIIIe siècle, le scientifique russe Mikhaïl Vassilievitch Lomonossov a apporté une énorme contribution au développement de la doctrine de la structure de la matière : « Les corps physiques sont divisés en parties les plus petites ». 12). Question : À votre avis, pourquoi étudions-nous la structure de la matière ? |
Ils apprennent qu'ils étudieront la chimie en 8e année. Enregistrement : M.V. Lomonossov. Ils donnent leurs réponses. |
| Diapositive numéro 18. L'émergence d'idées sur la structure de la matière a permis non seulement d'expliquer de nombreux phénomènes se produisant autour de nous, mais aussi de prédire comment ils se produiront dans certaines conditions. Il est devenu possible d'influencer l'origine des phénomènes, c'est-à-dire de contribuer à contrôler ces phénomènes. Connaissant la structure des corps, nous répondrons aux questions : pourquoi, lorsqu'ils sont chauffés, les solides se transforment en liquides, et les liquides en gaz ? Pourquoi le caoutchouc est-il élastique et la cire est-elle douce ? Pourquoi deux gouttes d'eau fusionnent-elles en une seule, mais en même temps deux billes d'acier rebondissent l'une sur l'autre lors de l'impact ? Nous répondrons à ces questions et à d’autres ; connaître la structure de la matière. |
|
| 4. Consolidation du nouveau matériel: Diapositive numéro 19. N° 1. Regardez la diapositive et répondez : Pourquoi une bille d'acier, qui passe librement à travers l'anneau, reste-t-elle coincée dans l'anneau après avoir chauffé ? Pourquoi le ballon ne peut-il pas traverser le ring, que s’est-il passé ? Oui, c'est exact. La matière est constituée de particules séparées par des espaces. Et si les particules s'éloignent les unes des autres, alors le volume du corps augmente. À l’inverse, lorsque les particules se rapprochent, le volume du corps diminue. |
Les élèves réfléchissent et donnent des réponses au problème. Tirer des conclusions sur les propriétés des molécules. Remarque : il existe des espaces entre les molécules. |
| Diapositive numéro 20. N° 2. La main de la statue dorée du temple grec antique, qui était embrassée par les paroissiens, est devenue très sensiblement plus fine au fil des décennies. Les prêtres sont paniqués : quelqu'un a volé l'or ? Ou est-ce un miracle, un signe ? Ce qui s'est passé? |
Les élèves réagissent et expriment leurs opinions. |
| Diapositive numéro 21. N°3. Pourquoi mon pantalon s'use-t-il ? #4 : Pourquoi les chaussures s'usent-elles ? 5. Réflexion sur la leçon : Diapositive n° 22. 1. Qu'avez-vous appris de nouveau dans cette leçon ? 2. Est-ce que cela vous sera utile dans la vie ? 3. Pendant le cours, étiez-vous intéressé à travailler, à écouter le professeur, à regarder la présentation ? 6. Notes de votre leçon : 7. Diapositive numéro 23. 8. Merci pour la leçon |
Écoutez les notes et les commentaires à leur sujet. |
Plan de la leçon : « Structure de la matière. Molécules"
(écrire dans les cahiers des élèves).

3 Voir beaucoup de choses dans un petit Objectifs de la leçon : 1. savoir de quoi est faite la matière 2. savoir comment la taille des molécules a été déterminée 3. savoir quels atomes sont les plus courants dans l'Univers 4. être capable d'appliquer ses connaissances sur la structure de important pour résoudre des problèmes qualitatifs "Une expérience, je valorise plus de mille opinions nées de l'imagination (M.V. Lomonossov)


5 La substance est constituée d'un grand nombre de minuscules particules. Un morceau de sucre a été jeté dans la mer Noire, dont la superficie est de m 2 et la profondeur est de 1 km. Maintenant, si nous puisons de l'eau n'importe où et à n'importe quelle profondeur, nous aurons jusqu'à 100 particules de sucre dans le seau.

6 Nombre de particules 1 cm 3 d'air 1 cm 3 contient des molécules de molécules par seconde - 9000 ans Boule avec de l'air 0,007 mm Population de la Terre

7 Tailles de particules Physicien anglais John Rayleigh (1842 – 1919) V = 1 mm 3 1 m 2 1 mm mm mm

8 tailles de particules Globe Particule Pomme (0, mm) (61 mm) (12742 km)



11 Molécules En 1647, Pierre Gassendi (physicien français) inventa le mot « molécule ». Une molécule est la plus petite particule d'une substance qui conserve ses propriétés chimiques. Les molécules d'une même substance sont les mêmes, mais différentes substances sont différentes (en taille, composition) Une molécule est constituée d'atomes Le mot « molécule » est traduit par « petite masse"





16 Structure de l'atome Scientifique anglais Ernest Rutherford () 1. Noyau atomique (100 mille fois plus petit qu'un atome) 2. Particules lumineuses - électrons - se déplacent autour du noyau Le noyau est constitué de particules : protons et neutrons.


18



Les phénomènes suivants sont connus : ramollissement du verre lorsqu'il est chauffé, ébullition de l'eau, combustion du bois, réaction du marbre avec l'acide chlorhydrique, lueur d'une ampoule électrique, combustion du kérosène, dissolution du sucre dans l'eau, gel de l'eau, changement de la forme d'un morceau de fer lors du forgeage, formation d'un précipité lors du mélange de deux solutions,
Phénomènes physiques
Phénomènes chimiques

Dans la liste ci-dessous, sélectionnez ceux qui sont chimiques et indiquez leurs caractéristiques :
fonte des glaces, buée du verre, fonte de la paraffine, brûlage des forêts, gel des plans d'eau, rouille du fer, pourriture des pommes, fermentation du chou lors du décapage
phénomène chimique
signe




Nous sommes entourés de divers articles ( corps ).
Par exemple:
règle de bureau en verre
Ces organismes sont composés de substances :
bois
verre
Plastique
Il existe de nombreuses substances dans le monde. Et ils sont tous constitués de les plus petites particules :
ATOMES et MOLÉCULES

Molécules - ce sont les plus petites particules qui composent les substances
- Molécule de substance - est la plus petite particule d'une substance donnée ..
- La plus petite particule d'eau est une molécule d'eau.
- La plus petite particule de sucre est une molécule de sucre.

ATOM - le plus petit produit chimique
particule indivisible
substances
ATOMES si petit
qu'est-ce qu'il y a sur la pointe d'une aiguille
beaucoup d'entre eux peuvent s'adapter des milliards.

Tailles moléculaires
Si les molécules ont pris la taille d'un point sur une feuille de papier. Ensuite, tous les corps augmenteraient également et le sommet de la Tour Eiffel atteindrait la Lune, les gens mesureraient 1700 km de haut, les souris feraient 100 km de long et les mouches feraient 7 km de long, chaque poil ferait 100 m d'épaisseur, le rouge cellules de notre sang - les globules rouges auraient un diamètre de 7 m.
H une personne est tellement de fois plus grosse qu'un atome, combien de fois est-elle plus petite que l'étoile.

- Voici un autre exemple : une goutte d'eau contient autant de molécules qu'il y a de gouttes dans la mer Noire

- Des particules aussi petites que des molécules ne peuvent pas être vues avec un simple microscope. Cependant, il existe microscopes électroniques et avec leur aide, il est devenu possible d'obtenir des photographies de molécules et même d'atomes.


Les atomes peuvent être vus dans les microscopes électroniques les plus modernes !
carbone
or
nickel

Composition d'une molécule d'eau
Molécules
molécules d'oxygène
hydrogène
molécules d'eau

Atome est la plus petite particule chimiquement indivisible d’une substance.
Modèles atomiques :
Les molécules sont des « compagnies » (groupes) d’atomes.
Molécule est la plus petite particule d'une substance qui conserve ses propriétés.
Modèles de molécules :

Le total existe 118 types d'atomes (89 dans la nature)
collection d'atomes un type sont appelés
CHIMIQUE ÉLÉMENT
Utilisé pour représenter différents atomes
SIGNES CHIMIQUES
(des lettres)

Panneaux
chimique
éléments

nom russe
Prononciation du signe
Nom latin
aluminium
aluminium
argentum

oxygène

béryllium
béryllium

manganèse
manganèse

hydrargyre

silicium


Tous les éléments connus sont placés dans un tableau créé par le grand scientifique russe
Dmitri Ivanovitch Mendeleïev :




Mythes des Grecs anciens
Titan-Ti
Le métal tire son nom des Titans, personnages de la mythologie grecque antique.

Éléments nommés d'après des corps célestes ou des planètes
système solaire
Sélénium (Se) – en l'honneur de la Lune.

Uranus (U) – en l'honneur d'Uranus
Neptunium (Np) – en l'honneur de Neptune

Éléments nommés d'après des états
Germanium (Ge) – en l'honneur de l'Allemagne
Porte de Brandebourg

Gallium (Ga), francium (Fr) – en l'honneur de la France
tour Eiffel

Ruthénium (Ru) n°44 – en l'honneur de la Russie
L'église Saint-Basile

Americium (Am) – en l'honneur de l'Amérique
Statue de la Liberté

Éléments nommés d'après des villes
Hafnium (Hf) – en l'honneur de Copenhague



Éléments nommés d'après des scientifiques
Curium (Cm) – en l'honneur de Pierre et Marie Curie



1. Les noms reflètent leurs propriétés les plus importantes.
Phosphore Chlore Brome
– vert clair et nauséabond

2. En l'honneur des corps célestes.
Tellure de sélénium du grec. Selena - Lune du grec. Telluris - Terre

Formes d'existence
élément chimique :
Substances simples
Substances complexes
Atomes libres

Formes d'existence de l'élément chimique hydrogène :
Atomes libres
Substance simple
Substance complexe
molécules d'eau
atomes d'hydrogène
molécules d'hydrogène

SUBSTANCES
simple
complexe
constitué d'atomes différent éléments chimiques
constitué d'atomes
un élément chimique

Substance simple
Substance complexe
Un mélange de deux
substances complexes
Un mélange de substances simples et complexes


Les structures des substances __________ sont constituées d’atomes ou d’ions
Les substances de structure moléculaire sont constituées de _______________

- Les substances ayant une structure moléculaire sont constituées de molécules
- Liquides ou gaz
- Les substances de structure non moléculaire sont constituées d'atomes ou d'ions
- Solides,
point de fusion bas
point de fusion élevé

Différences entre une substance simple et un élément chimique
Par exemple, lorsqu’ils disent : « L’oxygène est un gaz », il est évident qu’ils désignent une substance simple. Parce que les éléments ne peuvent pas être des gaz.
"Les animaux respirent de l'oxygène." Il y a aussi du fond ici. Parce qu'il est impossible de respirer l'élément.
"L'oxygène fait partie de l'alcool éthylique." Mais ici l'oxygène est un élément chimique.
"Les fils électriques sont en cuivre." Ici, le cuivre est une substance simple.
"Le cerveau humain a besoin de cuivre pour fonctionner." Mais nous parlons ici des plus petites quantités le cuivre comme élément .
"Le cuivre figure dans le tableau périodique." Bien entendu, vous ne trouverez aucun morceau de substance cuivrée dans le tableau. Cela signifie qu’il s’agit ici clairement d’un élément chimique. Plus précisément - symbole de l'élément chimique Cu .


- compilé par : professeur de physique
- Efimova L.N
- Tout ce dont les corps physiques sont faits s'appelle substance
- Structure de la matière. Molécule.
- Objectif de la leçon : Introduire le monde de la structure de la matière. Présenter aux élèves la structure de la matière. Donnez une idée des tailles des molécules.
- Héraclite a dit : le feu est la forme première de la matière.
- Thalès soutenait que l’origine de toutes choses sur terre était l’eau, à partir de laquelle toutes choses sont formées.
- 1. Un petit grain de gouache bleue a été dissous dans un récipient contenant de l'eau. L'eau est devenue bleue. 2. Versez un peu d'eau colorée dans le deuxième récipient et ajoutez-y de l'eau propre. La solution qu'il contient sera colorée, mais plus faible.
- 3. Depuis le deuxième récipient, versez la solution dans le troisième récipient et ajoutez à nouveau de l'eau propre. La solution dans le troisième récipient sera colorée, mais plus faiblement que dans le second.
- Nous avons dissous un tout petit grain de gouache dans l'eau et seule une partie s'est retrouvée dans le troisième récipient. Cela signifie que le grain lui-même était constitué d'un grand nombre de minuscules particules Cette expérience confirme l'hypothèse selon laquelle la matière est constituée de très petites particules.
- Corps physiques
- Particules
- Molécules
- Molécule une substance est la plus petite particule d’une substance donnée.
- Molécule en latin signifie "petite masse"
- On calcule que dans un volume de 1 cm3 d'air il y a environ 27 1018 molécules.
- Électronique
- microscope
- Molécule
- Atome traduit du grec ancien signifie « indivisible ».
- "O" est un atome d'oxygène.
- "H" est un atome d'hydrogène.
- 2 atomes d'hydrogène
- 1 atome d'oxygène
- Au XVIIIe siècle, le scientifique russe M.V. Lomonossov a grandement contribué au développement de la doctrine de la structure de la matière.
- « Les corps physiques sont divisés en plus petites parties. »
- L'émergence d'idées sur la structure de la matière a permis non seulement d'expliquer de nombreux phénomènes se produisant autour de nous, mais aussi de prédire comment ils se produiront dans certaines conditions.
- Il est devenu possible d'influencer l'origine des phénomènes, c'est-à-dire aider à gérer ces phénomènes.
- Expliquez en vous basant sur l'hypothèse de Démocrite sur l'existence de minuscules particules.
- Pourquoi une bille d'acier qui passe librement à travers l'anneau reste-t-elle coincée dans l'anneau après chauffage ?
- La main d'une statue dorée dans un temple grec antique, embrassée par les paroissiens, a sensiblement perdu du poids au fil des décennies. Les prêtres sont paniqués : quelqu'un a volé l'or ? Ou est-ce un miracle, un signe ? Ce qui s'est passé?
- Pourquoi les chaussures s'usent-elles ?
- Pourquoi mon pantalon s'use-t-il ?
- 1. Qu'avez-vous appris de nouveau en classe ?
- 2. Est-ce que cela vous sera utile dans la vie ?
- 3. La leçon était-elle intéressante ?