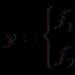· هيكل وآلية عمل الإنزيمات · الأشكال المتعددة للإنزيمات · الأهمية الطبية · الاستخدام العملي · ملاحظات · المؤلفات والميدوت
يتم تحديد نشاط الإنزيمات من خلال بنيتها ثلاثية الأبعاد.
مثل جميع البروتينات، يتم تصنيع الإنزيمات على شكل سلسلة خطية من الأحماض الأمينية، والتي تطوى بطريقة معينة. يتم طي كل تسلسل من الأحماض الأمينية بطريقة خاصة، ويكون للجزيء الناتج (كريات البروتين) خصائص فريدة. يمكن دمج عدة سلاسل بروتينية لتكوين مركب بروتيني. يتم تدمير البنية الثلاثية للبروتينات عن طريق الحرارة أو التعرض لبعض المواد الكيميائية.
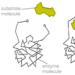
الموقع النشط للإنزيمات
إن دراسة آلية التفاعل الكيميائي المحفز بواسطة الإنزيم، إلى جانب تحديد المنتجات الوسيطة والنهائية في مراحل مختلفة من التفاعل، تعني معرفة دقيقة بهندسة البنية الثلاثية للإنزيم، وطبيعة المجموعات الوظيفية. لجزيئه، مما يوفر خصوصية العمل والنشاط التحفيزي العالي على هذه الركيزة، بالإضافة إلى الطبيعة الكيميائية للموقع (المواقع) لجزيء الإنزيم الذي يوفر معدلًا عاليًا من التفاعل التحفيزي. عادةً ما تكون جزيئات الركيزة المشاركة في التفاعلات الأنزيمية صغيرة الحجم نسبيًا مقارنة بجزيئات الإنزيم. وهكذا، أثناء تكوين مجمعات الإنزيم والركيزة، تدخل أجزاء محدودة فقط من تسلسل الأحماض الأمينية لسلسلة البولي ببتيد في تفاعل كيميائي مباشر - "المركز النشط" - وهو مزيج فريد من بقايا الأحماض الأمينية في جزيء الإنزيم، مما يضمن التفاعل المباشر مع جزيء الركيزة والمشاركة المباشرة في عملية الحفز.
ينقسم المركز النشط تقليديًا إلى:
- المركز الحفاز - يتفاعل كيميائيًا بشكل مباشر مع الركيزة؛
- مركز الارتباط (موقع الاتصال أو "المرساة") - يوفر تقاربًا محددًا للركيزة وتكوين مجمع الركيزة الإنزيمية.
لتحفيز التفاعل، يجب أن يرتبط الإنزيم بواحدة أو أكثر من الركائز. تطوى السلسلة البروتينية للإنزيم بحيث تتشكل فجوة، أو انخفاض، على سطح الكرية حيث ترتبط الركائز. تسمى هذه المنطقة موقع ربط الركيزة. عادة ما يتزامن مع الموقع النشط للإنزيم أو يكون قريبًا منه. تحتوي بعض الإنزيمات أيضًا على مواقع ربط للعوامل المساعدة أو الأيونات المعدنية.
يتحد الإنزيم مع الركيزة:
- ينظف الركيزة من الماء "معطف"
- يرتب جزيئات الركيزة المتفاعلة في الفضاء بالطريقة اللازمة لحدوث التفاعل
- تحضير جزيئات الركيزة للتفاعل (على سبيل المثال، الاستقطاب).
عادة، يرتبط الإنزيم بالركيزة من خلال الروابط الأيونية أو الهيدروجينية، ونادرًا من خلال الروابط التساهمية. وفي نهاية التفاعل، يتم فصل ناتجه (أو منتجاته) عن الإنزيم.
ونتيجة لذلك، يقلل الإنزيم من طاقة التنشيط للتفاعل. يحدث هذا لأنه في وجود الإنزيم يتبع التفاعل مسارًا مختلفًا (في الواقع يحدث تفاعل مختلف)، على سبيل المثال:
في غياب الانزيم:
- أ + ب = أ ب
في وجود الانزيم:
- أ + و = بالعربية
- AF+B = AVF
- AVF = AB+F
حيث A، B عبارة عن ركائز، AB هو منتج التفاعل، F هو الإنزيم.
لا تستطيع الإنزيمات توفير الطاقة بشكل مستقل للتفاعلات الداخلية (التي تتطلب طاقة لحدوثها). ولذلك، فإن الإنزيمات التي تقوم بمثل هذه التفاعلات تربطها بتفاعلات مولدة للطاقة والتي تطلق المزيد من الطاقة. على سبيل المثال، غالبًا ما تقترن تفاعلات تصنيع البوليمرات الحيوية بتفاعل التحلل المائي ATP.
تتميز المراكز النشطة لبعض الإنزيمات بظاهرة التعاونية.
النوعية
تظهر الإنزيمات عمومًا خصوصية عالية لركائزها (خصوصية الركيزة). يتم تحقيق ذلك من خلال التكامل الجزئي بين الشكل وتوزيع الشحنة والمناطق الكارهة للماء على جزيء الركيزة وموقع ربط الركيزة على الإنزيم. تظهر الإنزيمات أيضًا عادةً مستويات عالية من الخصوصية المجسمة (تشكيل واحد فقط من المتصاوغات الفراغية المحتملة كمنتج أو استخدام متصاوغ مجسم واحد فقط كركيزة)، والانتقائية الإقليمية (تشكيل أو كسر رابطة كيميائية في واحد فقط من المواضع المحتملة للركيزة)، و الانتقائية الكيميائية (تحفيز تفاعل كيميائي واحد فقط من عدة تفاعلات محتملة في ظروف معينة). على الرغم من المستوى العالي العام للخصوصية، قد تختلف درجة الركيزة ونوعية تفاعل الإنزيمات. على سبيل المثال، يكسر التربسين الإندوببتيداز فقط الرابطة الببتيدية بعد الأرجينين أو الليسين ما لم يتبعهما البرولين، لكن البيبسين أقل تحديدًا بكثير ويمكنه كسر الرابطة الببتيدية بعد العديد من الأحماض الأمينية.
نموذج قفل المفتاح

في عام 1890، اقترح إميل فيشر أن خصوصية الإنزيمات يتم تحديدها من خلال التطابق التام بين شكل الإنزيم والركيزة. ويسمى هذا الافتراض نموذج قفل المفتاح. يتحد الإنزيم مع الركيزة لتكوين مركب إنزيم-ركيزة قصير العمر. وفي الوقت نفسه، على الرغم من أن هذا النموذج يفسر الخصوصية العالية للإنزيمات، فإنه لا يفسر ظاهرة استقرار الحالة الانتقالية، والتي يتم ملاحظتها في الممارسة العملية.
نموذج المراسلات المستحثة
في عام 1958، اقترح دانييل كوشلاند تعديل نموذج "القفل الرئيسي". الإنزيمات بشكل عام ليست جزيئات صلبة ولكنها مرنة. يمكن للموقع النشط للإنزيم تغيير التشكل بعد ربط الركيزة. تتخذ المجموعات الجانبية للأحماض الأمينية للموقع النشط موقعًا يسمح للإنزيم بأداء وظيفته التحفيزية. في بعض الحالات، يتغير شكل جزيء الركيزة أيضًا بعد الارتباط بالموقع النشط. على عكس نموذج قفل المفتاح، لا يفسر نموذج التوافق المستحث خصوصية الإنزيمات فحسب، بل يفسر أيضًا استقرار الحالة الانتقالية. ويسمى هذا النموذج "يد القفاز".
التعديلات
تخضع العديد من الإنزيمات لتعديلات بعد تركيب سلسلة البروتين، والتي بدونها لا يظهر الإنزيم نشاطه بشكل كامل. تسمى هذه التعديلات تعديلات ما بعد الترجمة (المعالجة). أحد أكثر أنواع التعديل شيوعًا هو إضافة المجموعات الكيميائية إلى المخلفات الجانبية لسلسلة البولي ببتيد. على سبيل المثال، تسمى إضافة بقايا حمض الفوسفوريك الفسفرة ويتم تحفيزها بواسطة إنزيم كيناز. العديد من الإنزيمات حقيقية النواة تكون غليكوزيلاتيد، أي يتم تعديلها بواسطة قليلات القسيم ذات الطبيعة الكربوهيدراتية.
هناك نوع شائع آخر من التعديلات ما بعد الترجمة وهو انقسام سلسلة البولي ببتيد. على سبيل المثال، يتم الحصول على الكيموتربسين (وهو بروتياز يشارك في عملية الهضم) عن طريق شق منطقة عديد الببتيد من مولد الكيموتربسين. مولد الكيموتربسين هو طليعة غير نشطة للكيموتربسين ويتم تصنيعه في البنكرياس. يتم نقل الشكل غير النشط إلى المعدة، حيث يتم تحويله إلى كيموتربسين. هذه الآلية ضرورية لتجنب انقسام البنكرياس والأنسجة الأخرى قبل دخول الإنزيم إلى المعدة. يُطلق على سلائف الإنزيم غير النشط أيضًا اسم "zymogen".
العوامل المساعدة الإنزيمية
تؤدي بعض الإنزيمات الوظيفة التحفيزية من تلقاء نفسها، دون أي مكونات إضافية. ومع ذلك، هناك إنزيمات تتطلب مكونات غير بروتينية للقيام بالتحفيز. يمكن أن تكون العوامل المساعدة إما جزيئات غير عضوية (أيونات المعادن، مجموعات الحديد والكبريت، إلخ) أو عضوية (على سبيل المثال، الفلافين أو الهيم). وتسمى العوامل المساعدة العضوية المرتبطة بشدة بالإنزيم أيضًا بالمجموعات الاصطناعية. تسمى العوامل المساعدة العضوية التي يمكن فصلها عن الإنزيم بالإنزيمات المساعدة.
الإنزيم الذي يتطلب وجود عامل مساعد للنشاط التحفيزي، ولكنه غير مرتبط به، يسمى إنزيم apo. يُطلق على إنزيم apo مع العامل المساعد اسم إنزيم هولو. ترتبط معظم العوامل المساعدة بالإنزيم عن طريق تفاعلات غير تساهمية ولكنها قوية إلى حد ما. هناك أيضًا مجموعات صناعية ترتبط تساهميًا بالإنزيم، على سبيل المثال، بيروفوسفات الثيامين في نازع هيدروجين البيروفات.
تنظيم الانزيمات
تحتوي بعض الإنزيمات على مواقع ربط جزيئية صغيرة وقد تكون ركائز أو منتجات للمسار الأيضي الذي يدخل فيه الإنزيم. أنها تقلل أو تزيد من نشاط الإنزيم، مما يخلق فرصة للتغذية الراجعة.
تثبيط المنتج النهائي
المسار الأيضي عبارة عن سلسلة من التفاعلات الأنزيمية المتسلسلة. غالبًا ما يكون المنتج النهائي للمسار الأيضي هو مثبط للإنزيم الذي يسرع التفاعل الأول في هذا المسار الأيضي. إذا كان المنتج النهائي أكثر من اللازم، فإنه يعمل كمثبط للإنزيم الأول، وإذا كان المنتج النهائي بعد ذلك قليلًا جدًا، فسيتم تنشيط الإنزيم الأول مرة أخرى. وبالتالي، فإن تثبيط المنتج النهائي وفقًا لمبدأ ردود الفعل السلبية هو وسيلة مهمة للحفاظ على التوازن (الثبات النسبي لظروف البيئة الداخلية للجسم).
تأثير الظروف البيئية على نشاط الانزيم
يعتمد نشاط الإنزيمات على الظروف الموجودة في الخلية أو الجسم - الضغط، وحموضة البيئة، ودرجة الحرارة، وتركيز الأملاح الذائبة (القوة الأيونية للمحلول)، وما إلى ذلك.
الإنزيمات
المواد العضوية ذات الطبيعة البروتينية التي يتم تصنيعها في الخلايا وتسرع التفاعلات التي تحدث فيها عدة مرات دون الخضوع للتحولات الكيميائية. المواد التي لها تأثير مماثل موجودة أيضًا في الطبيعة غير الحية وتسمى المحفزات. تُسمى الإنزيمات (من الكلمة اللاتينية Fermentum - التخمير، الخميرة) أحيانًا بالإنزيمات (من الكلمة اليونانية en - الداخل، zyme - خميرة). تحتوي جميع الخلايا الحية على مجموعة كبيرة جدًا من الإنزيمات، التي يحدد نشاطها التحفيزي عمل الخلايا. تقريبًا كل تفاعل من التفاعلات العديدة المختلفة التي تحدث في الخلية يتطلب مشاركة إنزيم معين. تعد دراسة الخواص الكيميائية للإنزيمات والتفاعلات التي تحفزها موضوعًا لمجال خاص وهام جدًا من الكيمياء الحيوية - علم الإنزيمات. العديد من الإنزيمات تكون في حالة حرة في الخلية، وتذوب ببساطة في السيتوبلازم؛ ويرتبط البعض الآخر بهياكل معقدة ومنظمة للغاية. هناك أيضًا إنزيمات توجد عادةً خارج الخلية؛ وهكذا، يفرز البنكرياس الإنزيمات التي تحفز تحلل النشا والبروتينات إلى الأمعاء. تفرز بواسطة الإنزيمات والعديد من الكائنات الحية الدقيقة. تم الحصول على البيانات الأولى عن الإنزيمات من دراسة عمليات التخمير والهضم. قدم L. Pasteur مساهمة كبيرة في دراسة التخمر، لكنه كان يعتقد أن الخلايا الحية فقط هي التي يمكنها تنفيذ التفاعلات المقابلة. في بداية القرن العشرين. أظهر E. Buchner أن تخمير السكروز لتكوين ثاني أكسيد الكربون والكحول الإيثيلي يمكن تحفيزه بواسطة مستخلص الخميرة الخالية من الخلايا. وقد حفز هذا الاكتشاف المهم على عزل ودراسة الإنزيمات الخلوية. في عام 1926، قام ج. سومنر من جامعة كورنيل (الولايات المتحدة الأمريكية) بعزل اليورياز؛ كان أول إنزيم تم الحصول عليه في شكل نقي تقريبًا. ومنذ ذلك الحين، تم اكتشاف وعزل أكثر من 700 إنزيم، ولكن يوجد الكثير منها في الكائنات الحية. يحتل تحديد وعزل ودراسة خصائص الإنزيمات الفردية مكانًا مركزيًا في علم الإنزيمات الحديث. الإنزيمات المشاركة في عمليات تحويل الطاقة الأساسية، مثل تحلل السكريات والتكوين والتحلل المائي لمركب أدينوزين ثلاثي الفوسفات عالي الطاقة (ATP)، موجودة في جميع أنواع الخلايا - الحيوانية والنباتية والبكتيرية. ومع ذلك، هناك إنزيمات يتم إنتاجها فقط في أنسجة بعض الكائنات الحية. وهكذا، فإن الإنزيمات المشاركة في تخليق السليلوز توجد في الخلايا النباتية، ولكن ليس في الخلايا الحيوانية. وبالتالي، من المهم التمييز بين الإنزيمات "العالمية" والإنزيمات الخاصة بأنواع معينة من الخلايا. بشكل عام، كلما كانت الخلية أكثر تخصصًا، زاد احتمال تصنيع مجموعة الإنزيمات اللازمة لأداء وظيفة خلوية معينة.
الإنزيمات تشبه البروتينات.جميع الإنزيمات عبارة عن بروتينات، بسيطة أو معقدة (أي تحتوي، إلى جانب مكون البروتين، على جزء غير بروتيني).
انظر أيضًا البروتينات. الإنزيمات عبارة عن جزيئات كبيرة، يتراوح وزنها الجزيئي من 10.000 إلى أكثر من 1.000.000 دالتون (Da). وللمقارنة نشير إلى ذلك كتل المواد المعروفة: الجلوكوز - 180، ثاني أكسيد الكربون - 44، الأحماض الأمينية - من 75 إلى 204 دا. الإنزيمات التي تحفز نفس التفاعلات الكيميائية، ولكنها معزولة عن أنواع مختلفة من الخلايا، تختلف في الخصائص والتركيب، ولكن عادة ما يكون لها تشابه معين في البنية. يتم فقدان السمات الهيكلية للإنزيمات الضرورية لعملها بسهولة. وهكذا، عند تسخينها، تحدث إعادة هيكلة سلسلة البروتين، مصحوبة بفقدان النشاط التحفيزي. الخصائص القلوية أو الحمضية للمحلول مهمة أيضًا. تعمل معظم الإنزيمات بشكل أفضل في المحاليل التي يكون الرقم الهيدروجيني فيها قريبًا من 7، عندما يكون تركيز أيونات H+ وOH- متماثلًا تقريبًا. ويرجع ذلك إلى حقيقة أن بنية جزيئات البروتين، وبالتالي نشاط الإنزيمات، تعتمد بشدة على تركيز أيونات الهيدروجين في الوسط. ليست كل البروتينات الموجودة في الكائنات الحية هي إنزيمات. وبالتالي، يتم تنفيذ وظيفة مختلفة عن طريق البروتينات الهيكلية، والعديد من بروتينات الدم المحددة، والهرمونات البروتينية، وما إلى ذلك.
الإنزيمات والركائز.تظهر العديد من الإنزيمات ذات الوزن الجزيئي الكبير نشاطًا تحفيزيًا فقط في وجود مواد محددة ذات وزن جزيئي منخفض تسمى الإنزيمات المساعدة (أو العوامل المساعدة). تلعب معظم الفيتامينات والعديد من المعادن دور الإنزيمات المساعدة. ولهذا يجب أن تدخل الجسم مع الطعام. الفيتامينات PP (حمض النيكوتينيك، أو النياسين) والريبوفلافين، على سبيل المثال، هي جزء من الإنزيمات المساعدة اللازمة لعمل نازعة الهيدروجين. الزنك هو أنزيم من الأنهيدراز الكربونيك، وهو إنزيم يحفز إطلاق ثاني أكسيد الكربون من الدم، والذي يتم إزالته من الجسم مع هواء الزفير. يعمل الحديد والنحاس كمكونات لإنزيم السيتوكروم أوكسيديز التنفسي. تسمى المادة التي تخضع للتحول في وجود الإنزيم بالركيزة. ترتبط الركيزة بإنزيم، مما يؤدي إلى تسريع كسر بعض الروابط الكيميائية في جزيئها وإنشاء روابط أخرى؛ يتم فصل المنتج الناتج عن الإنزيم. وتتمثل هذه العملية على النحو التالي:
يمكن أيضًا اعتبار المنتج ركيزة، نظرًا لأن جميع التفاعلات الأنزيمية قابلة للعكس بدرجة أو بأخرى. صحيح أن التوازن عادة ما يتحول نحو تكوين المنتج، وقد يكون من الصعب اكتشاف التفاعل العكسي.
آلية عمل الانزيمات.يعتمد معدل التفاعل الأنزيمي على تركيز الركيزة [[S]] وكمية الإنزيم الموجود. تحدد هذه الكميات عدد جزيئات الإنزيم التي ستتحد مع الركيزة، ويعتمد معدل التفاعل المحفز بواسطة هذا الإنزيم على محتوى مركب الإنزيم والركيزة. في معظم الحالات التي تهم علماء الكيمياء الحيوية، يكون تركيز الإنزيم منخفضًا جدًا وتكون الركيزة موجودة بشكل زائد. بالإضافة إلى ذلك، يدرس علماء الكيمياء الحيوية العمليات التي وصلت إلى حالة مستقرة، حيث يتم موازنة تكوين مركب الإنزيم والركيزة من خلال تحوله إلى منتج. في ظل هذه الظروف، يتم وصف اعتماد المعدل (v) للتحول الأنزيمي للركيزة على تركيزها [[S]] بواسطة معادلة ميكايليس-مينتن:

حيث KM هو ثابت ميكايليس، الذي يميز نشاط الإنزيم، وV هو الحد الأقصى لمعدل التفاعل عند تركيز إجمالي معين للإنزيم. ويترتب على هذه المعادلة أنه عند [[S]] الصغيرة، يزداد معدل التفاعل بما يتناسب مع تركيز الركيزة. ومع ذلك، مع زيادة كبيرة بما فيه الكفاية في الأخير، يختفي هذا التناسب: يتوقف معدل التفاعل عن الاعتماد على [[S]] - يحدث التشبع عندما تشغل الركيزة جميع جزيئات الإنزيم. إن توضيح آليات عمل الإنزيمات بكل تفاصيلها أمر يتعلق بالمستقبل، ولكن تم بالفعل تحديد بعض سماتها المهمة. يحتوي كل إنزيم على موقع نشط واحد أو أكثر ترتبط به الركيزة. هذه المراكز محددة للغاية، أي. "التعرف" فقط على الركيزة أو المركبات ذات الصلة الوثيقة. ويتكون المركز النشط من مجموعات كيميائية خاصة في جزيء الإنزيم، موجهة بالنسبة لبعضها البعض بطريقة معينة. ويرتبط فقدان النشاط الأنزيمي الذي يحدث بهذه السهولة على وجه التحديد بالتغير في التوجه المتبادل لهذه المجموعات. يخضع جزيء الركيزة المرتبط بالإنزيم للتغيرات، ونتيجة لذلك يتم كسر بعض الروابط الكيميائية وتشكل روابط كيميائية أخرى. ولكي تحدث هذه العملية، هناك حاجة إلى الطاقة؛ يتمثل دور الإنزيم في خفض حاجز الطاقة الذي يجب على الركيزة التغلب عليه لتحويله إلى منتج. ولم يتم تحديد كيفية ضمان هذا التخفيض بشكل كامل.
التفاعلات الأنزيمية والطاقة.يتم إطلاق الطاقة من استقلاب المغذيات، مثل أكسدة سكر الجلوكوز المكون من ستة ذرات كربون لتكوين ثاني أكسيد الكربون والماء، من خلال سلسلة من التفاعلات الأنزيمية المتضافرة. في الخلايا الحيوانية، تشارك 10 إنزيمات مختلفة في تحويل الجلوكوز إلى حمض البيروفيك (البيروفات) أو حمض اللاكتيك (اللاكتات). وتسمى هذه العملية تحلل السكر. التفاعل الأول، فسفرة الجلوكوز، يتطلب مشاركة ATP. يتطلب تحويل كل جزيء من الجلوكوز إلى جزيئين من حمض البيروفيك جزيئين من ATP، ولكن في المراحل المتوسطة يتم تشكيل 4 جزيئات من ATP من ثنائي فوسفات الأدينوزين (ADP)، وبالتالي تنتج العملية برمتها جزيئين من ATP. بعد ذلك، يتم أكسدة حمض البيروفيك إلى ثاني أكسيد الكربون والماء بمشاركة الإنزيمات المرتبطة بالميتوكوندريا. تشكل هذه التحولات دورة تسمى دورة حمض ثلاثي الكربوكسيل أو دورة حمض الستريك.
انظر أيضًا الأيض. ترتبط أكسدة مادة ما دائمًا باختزال مادة أخرى: فالأولى تتخلى عن ذرة هيدروجين، والثانية تضيفها. يتم تحفيز هذه العمليات بواسطة إنزيمات الهيدروجين، والتي تضمن نقل ذرات الهيدروجين من الركائز إلى الإنزيمات المساعدة. في دورة حمض ثلاثي الكربوكسيل، تعمل بعض إنزيمات الهيدروجين المحددة على أكسدة الركائز لتكوين شكل مخفض من الإنزيم المساعد (نيكوتيناميد ثنائي النوكليوتيد، المعين NAD)، في حين أن البعض الآخر يؤكسد الإنزيم المساعد المخفض (NADCH)، مما يقلل من إنزيمات الجهاز التنفسي الأخرى، بما في ذلك السيتوكروم (الهيموبروتينات المحتوية على الحديد). ، حيث تتناوب ذرة الحديد بين المؤكسد، ثم المختزل. في النهاية، يتأكسد الشكل المخفض من أوكسيديز السيتوكروم، وهو أحد الإنزيمات الرئيسية المحتوية على الحديد، عن طريق دخول الأكسجين إلى الجسم مع الهواء المستنشق. عندما يحترق السكر (الأكسدة بواسطة الأكسجين الجوي)، تتفاعل ذرات الكربون الموجودة فيه بشكل مباشر مع الأكسجين، لتشكل ثاني أكسيد الكربون. على عكس الاحتراق، عندما يتأكسد السكر في الجسم، يؤكسد الأكسجين حديد السيتوكروم أوكسيديز نفسه، ولكن إمكاناته التأكسدية تستخدم في النهاية لأكسدة السكريات بالكامل في عملية متعددة الخطوات بوساطة الإنزيمات. في مراحل معينة من الأكسدة، يتم إطلاق الطاقة الموجودة في العناصر الغذائية بشكل رئيسي في أجزاء صغيرة ويمكن تخزينها في روابط الفوسفات في ATP. وتشارك في ذلك إنزيمات رائعة، حيث تجمع بين التفاعلات المؤكسدة (توفير الطاقة) وتفاعلات تكوين ATP (تخزين الطاقة). تُعرف عملية الاقتران هذه باسم الفسفرة التأكسدية. وبدون التفاعلات الأنزيمية المقترنة، لن تكون الحياة بالأشكال التي نعرفها ممكنة. تؤدي الإنزيمات أيضًا العديد من الوظائف الأخرى. إنها تحفز مجموعة متنوعة من التفاعلات التوليفية، بما في ذلك تكوين بروتينات الأنسجة والدهون والكربوهيدرات. تُستخدم أنظمة إنزيمية كاملة لتخليق مجموعة واسعة من المركبات الكيميائية الموجودة في الكائنات الحية المعقدة. وهذا يتطلب طاقة، ومصدرها في جميع الأحوال هو مركبات مفسفرة مثل ATP.


الانزيمات والهضم.الإنزيمات هي المشاركين الضروريين في عملية الهضم. فقط المركبات ذات الوزن الجزيئي المنخفض هي التي يمكنها المرور عبر جدار الأمعاء ودخول مجرى الدم، لذلك يجب أولاً تقسيم مكونات الطعام إلى جزيئات صغيرة. يحدث هذا أثناء التحلل المائي الأنزيمي (تكسير) البروتينات إلى أحماض أمينية، والنشا إلى سكريات، والدهون إلى أحماض دهنية وجلسرين. يتم تحفيز التحلل المائي للبروتين بواسطة إنزيم البيبسين الموجود في المعدة. يتم إفراز عدد من الإنزيمات الهاضمة عالية الفعالية في الأمعاء عن طريق البنكرياس. هذه هي التربسين والكيموتربسين، الذي يتحلل البروتينات. الليباز الذي يكسر الدهون. الأميليز، الذي يحفز انهيار النشا. يتم إفراز البيبسين والتربسين والكيموتربسين بشكل غير نشط، على شكل ما يسمى. الإنزيمات (الإنزيمات الأولية)، وتصبح نشطة فقط في المعدة والأمعاء. وهذا ما يفسر عدم قيام هذه الإنزيمات بتدمير خلايا البنكرياس والمعدة. جدران المعدة والأمعاء محمية من الإنزيمات الهضمية وطبقة من المخاط. تفرز خلايا الأمعاء الدقيقة العديد من الإنزيمات الهضمية المهمة. تتركز معظم الطاقة المخزنة في الأطعمة النباتية، مثل العشب أو القش، في السليلوز، الذي يتم تكسيره بواسطة إنزيم السليلوز. لا يتم تصنيع هذا الإنزيم في جسم الحيوانات العاشبة، ويمكن للحيوانات المجترة، مثل الأبقار والأغنام، تناول الأطعمة التي تحتوي على السليلوز فقط لأن السليلوز يتم إنتاجه بواسطة الكائنات الحية الدقيقة التي تسكن القسم الأول من المعدة - الكرش. يستخدم النمل الأبيض أيضًا الكائنات الحية الدقيقة لهضم الطعام. تستخدم الإنزيمات في الصناعات الغذائية والأدوية والكيميائية والنسيجية. ومن الأمثلة على ذلك إنزيم نباتي يتم الحصول عليه من البابايا ويستخدم لتطرية اللحوم. تضاف الإنزيمات أيضًا إلى مساحيق الغسيل.
الانزيمات في الطب والزراعة.أدى الوعي بالدور الرئيسي للإنزيمات في جميع العمليات الخلوية إلى استخدامها على نطاق واسع في الطب والزراعة. يعتمد الأداء الطبيعي لأي كائن نباتي وحيواني على عمل فعالالانزيمات. يعتمد عمل العديد من المواد السامة (السموم) على قدرتها على تثبيط الإنزيمات؛ هناك عدد من الأدوية لها نفس التأثير. في كثير من الأحيان يمكن تتبع تأثير دواء أو مادة سامة من خلال تأثيره الانتقائي على عمل إنزيم معين في الجسم ككل أو في نسيج معين. على سبيل المثال، فإن المبيدات الحشرية الفوسفورية العضوية القوية وغازات الأعصاب التي تم تطويرها للأغراض العسكرية لها تأثيرها المدمر من خلال منع عمل الإنزيمات - في المقام الأول الكولينستراز، الذي يلعب دورًا مهمًا في نقل النبضات العصبية. لفهم آلية عمل الأدوية على أنظمة الإنزيمات بشكل أفضل، من المفيد النظر في كيفية عمل بعض مثبطات الإنزيمات. ترتبط العديد من المثبطات بالموقع النشط للإنزيم - وهو نفس الموقع الذي تتفاعل معه الركيزة. في مثل هذه المثبطات، تكون السمات الهيكلية الأكثر أهمية قريبة من السمات الهيكلية للركيزة، وإذا كان كل من الركيزة والمثبط موجودين في وسط التفاعل، فهناك منافسة بينهما للارتباط بالإنزيم؛ علاوة على ذلك، كلما زاد تركيز الركيزة، زاد نجاحها في التنافس مع المانع. مثبطات من نوع آخر تحفز تغييرات تكوينية في جزيء الإنزيم، والتي تتضمن مجموعات كيميائية مهمة وظيفيًا. تساعد دراسة آلية عمل المثبطات الكيميائيين على إنتاج أدوية جديدة.
في كثير من الأحيان، إلى جانب الفيتامينات والمعادن والعناصر الأخرى المفيدة لجسم الإنسان، يتم ذكر مواد تسمى الإنزيمات. ما هي الإنزيمات وما الوظيفة التي تؤديها في الجسم وما طبيعتها وأين تتواجد؟
هذه هي مواد ذات طبيعة بروتينية ومحفزات حيوية. بدونها لن يكون هناك أغذية الأطفال أو الحبوب الجاهزة أو الكفاس أو جبن الفيتا أو الجبن أو الزبادي أو الكفير. أنها تؤثر على عمل جميع أجهزة الجسم البشري. النشاط غير الكافي أو المفرط لهذه المواد يؤثر سلباً على الصحة، لذا عليك معرفة ما هي الإنزيمات لتجنب المشاكل الناجمة عن نقصها.
ما هو؟
الإنزيمات هي جزيئات بروتينية يتم تصنيعها بواسطة الخلايا الحية. هناك أكثر من مائة منهم في كل خلية. دور هذه المواد هائل. أنها تؤثر على معدل التفاعلات الكيميائية عند درجات حرارة مناسبة لكائن معين. الاسم الآخر للإنزيمات هو المحفزات البيولوجية. تحدث زيادة في معدل التفاعل الكيميائي بسبب تسهيل حدوثه. كمحفزات، لا يتم استهلاكها أثناء التفاعل ولا تغير اتجاهه. تتمثل الوظائف الرئيسية للإنزيمات في أنه بدونها ستسير جميع التفاعلات في الكائنات الحية ببطء شديد، وهذا من شأنه أن يؤثر بشكل كبير على قابلية الحياة.
على سبيل المثال، عند مضغ الأطعمة التي تحتوي على النشا (البطاطا، الأرز)، يظهر طعم حلو في الفم، والذي يرتبط بعمل الأميليز، وهو إنزيم لتكسير النشا الموجود في اللعاب. النشا نفسه لا طعم له، لأنه عبارة عن عديد السكاريد. منتجات تحللها (السكريات الأحادية) لها طعم حلو: الجلوكوز والمالتوز والدكسترين.
وتنقسم جميعها إلى بسيطة ومعقدة. الأول يتكون فقط من البروتين، في حين أن الأخير يتكون من البروتين (الإنزيم المساعد) وجزء غير البروتين (الإنزيم المساعد). يمكن أن تكون فيتامينات المجموعات B، E، K عبارة عن إنزيمات مساعدة.
فئات الانزيمات
تقليديا، يتم تقسيم هذه المواد إلى ست مجموعات. تم تسميتها في الأصل بناءً على الركيزة التي يعمل عليها إنزيم معين، وذلك عن طريق إضافة النهاية -ase إلى جذرها. وهكذا، بدأت تسمى تلك الإنزيمات التي تحلل البروتينات (البروتينات) بالبروتينات والدهون (الليبوز) - الليباز والنشا (الأميلون) - الأميليز. ثم تلقت الإنزيمات التي تحفز تفاعلات مماثلة أسماء تشير إلى نوع التفاعل المقابل - أسيلاز، ديكاربوكسيلاز، أوكسيديز، ديهيدروجينيز وغيرها. ولا تزال معظم هذه الأسماء قيد الاستخدام حتى اليوم.

في وقت لاحق، قدم الاتحاد الكيميائي الحيوي الدولي التسميات التي بموجبها يجب أن يتوافق اسم وتصنيف الإنزيمات مع نوع وآلية التفاعل الكيميائي المحفز. جلبت هذه الخطوة الراحة في تنظيم البيانات التي تتعلق بمختلف جوانب عملية التمثيل الغذائي. تنقسم التفاعلات والإنزيمات التي تحفزها إلى ستة فئات. يتكون كل فئة من عدة فئات فرعية (4-13). الجزء الأول من اسم الإنزيم يتوافق مع اسم الركيزة، والثاني - لنوع التفاعل المحفز بالنهاية -aza. كل إنزيم حسب التصنيف (CF) له رقم كود خاص به. الرقم الأول يتوافق مع فئة رد الفعل، الذي يليه فئة فرعية، والثالث إلى فئة فرعية. يشير الرقم الرابع إلى رقم الإنزيم بالترتيب في فئته الفرعية. على سبيل المثال، إذا كانت EC 2.7.1.1، فإن الإنزيم ينتمي إلى الفئة الثانية، والفئة الفرعية السابعة، والفئة الفرعية الأولى. يشير الرقم الأخير إلى إنزيم هيكسوكيناز.
معنى
إذا تحدثنا عن ماهية الإنزيمات، فلا يمكننا تجاهل مسألة أهميتها في العالم الحديث. لقد وجدت تطبيقًا واسعًا في جميع قطاعات النشاط البشري تقريبًا. يرجع انتشارها إلى قدرتها على الاحتفاظ بخصائصها الفريدة خارج الخلايا الحية. في الطب، على سبيل المثال، يتم استخدام الإنزيمات من مجموعات الليباز والبروتياز والأميليز. إنهم يكسرون الدهون والبروتينات والنشا. وكقاعدة عامة، يتم تضمين هذا النوع في أدوية مثل بانزينورم وفيستال. تستخدم هذه الأدوية في المقام الأول لعلاج أمراض الجهاز الهضمي. بعض الإنزيمات قادرة على إذابة جلطات الدم في الأوعية الدموية؛ فهي تساعد في علاج الجروح القيحية. يحتل العلاج الإنزيمي مكانة خاصة في علاج السرطان.

نظرا لقدرته على تحطيم النشا، يستخدم إنزيم الأميليز على نطاق واسع في صناعة المواد الغذائية. في نفس المنطقة، يتم استخدام الليباز، الذي يكسر الدهون، والبروتياز، الذي يكسر البروتينات. تستخدم إنزيمات الأميليز في صناعة التخمير وصناعة النبيذ والخبز. يستخدم البروتياز في تحضير العصيدة الجاهزة وتليين اللحوم. يتم استخدام الليباز والمنفحة في إنتاج الجبن. صناعة مستحضرات التجميل أيضًا لا يمكنها الاستغناء عنها. يتم تضمينها في مساحيق الغسيل والكريمات. على سبيل المثال، يتم إضافة الأميليز، الذي يكسر النشا، إلى مساحيق الغسيل. يتم تكسير بقع البروتين والبروتينات بواسطة البروتياز، ويقوم الليباز بتنظيف نسيج الزيت والدهون.
دور الانزيمات في الجسم
هناك عمليتان مسؤولتان عن عملية التمثيل الغذائي في جسم الإنسان: عملية التمثيل الغذائي والتقويض. الأول يضمن امتصاص الطاقة والمواد الضرورية، والثاني - انهيار النفايات. ويؤثر التفاعل المستمر لهذه العمليات على امتصاص الكربوهيدرات والبروتينات والدهون والحفاظ على وظائف الجسم الحيوية. يتم تنظيم العمليات الأيضية من خلال ثلاثة أنظمة: الجهاز العصبي والغدد الصماء والدورة الدموية. ويمكن أن تعمل بشكل طبيعي بمساعدة سلسلة من الإنزيمات، والتي بدورها تضمن تكيف الإنسان مع التغيرات في الظروف البيئية الخارجية والداخلية. تشمل الإنزيمات كلاً من المنتجات البروتينية وغير البروتينية.
في عملية التفاعلات الكيميائية الحيوية في الجسم، والتي تشارك فيها الإنزيمات، لا يتم استهلاكها. ولكل منها تركيب كيميائي مختلف ودور فريد، لذلك يبدأ كل منها تفاعلًا محددًا فقط. تساعد المحفزات البيوكيميائية المستقيم والرئتين والكلى والكبد على إزالة السموم والفضلات من الجسم. كما أنها تساعد في بناء الجلد والعظام والخلايا العصبية والأنسجة العضلية. تستخدم إنزيمات محددة لأكسدة الجلوكوز.

تنقسم جميع الإنزيمات الموجودة في الجسم إلى التمثيل الغذائي والجهاز الهضمي. وتشارك عملية التمثيل الغذائي في تحييد السموم، وإنتاج البروتينات والطاقة، وتسريع العمليات الكيميائية الحيوية في الخلايا. على سبيل المثال، ديسموتاز الفائق أكسيد هو أقوى مضادات الأكسدةوالتي توجد بشكل طبيعي في معظم النباتات الخضراء والملفوف وكرنب بروكسل والقرنبيط وبراعم القمح والخضر والشعير.
نشاط الانزيم
لكي تؤدي هذه المواد وظائفها بشكل كامل، هناك شروط معينة ضرورية. يتأثر نشاطهم في المقام الأول بدرجة الحرارة. وعند زيادته يزداد معدل التفاعلات الكيميائية. ونتيجة لزيادة سرعة الجزيئات، تزداد فرصة اصطدامها ببعضها البعض، وبالتالي تزداد احتمالية حدوث التفاعل. درجة الحرارة المثالية تضمن أكبر قدر من النشاط. بسبب تمسخ البروتين، الذي يحدث عندما تنحرف درجة الحرارة المثلى عن القاعدة، ينخفض معدل التفاعل الكيميائي. عندما تصل درجة الحرارة إلى درجة التجمد، لا يفسد الإنزيم، بل يتم تعطيله. تعمل طريقة التجميد السريع، المستخدمة على نطاق واسع لتخزين المنتجات على المدى الطويل، على إيقاف نمو وتطور الكائنات الحية الدقيقة، يليها تعطيل الإنزيمات الموجودة بالداخل. ونتيجة لذلك، لا يتحلل الطعام.
يتأثر نشاط الإنزيم أيضًا بالحموضة بيئة. إنهم يعملون عند درجة حموضة محايدة. فقط بعض الإنزيمات تعمل في البيئات القلوية أو القلوية القوية أو الحمضية أو شديدة الحموضة. على سبيل المثال، تقوم المنفحة بتكسير البروتينات في البيئة شديدة الحموضة في معدة الإنسان. يمكن أن يتأثر الإنزيم بالمثبطات والمنشطات. يتم تنشيطها بواسطة بعض الأيونات، على سبيل المثال، المعادن. الأيونات الأخرى لها تأثير مثبط على نشاط الإنزيم.

فرط النشاط
النشاط المفرط للإنزيم له عواقب على عمل الكائن الحي بأكمله. أولا، فإنه يثير زيادة في معدل عمل الإنزيم، والذي بدوره يؤدي إلى نقص الركيزة التفاعل وتشكيل فائض من منتج التفاعل الكيميائي. يؤدي نقص الركائز وتراكم هذه المنتجات إلى تفاقم الحالة الصحية بشكل كبير، ويعطل الوظائف الحيوية للجسم، ويسبب تطور الأمراض ويمكن أن يؤدي إلى وفاة الشخص. فتراكم حمض اليوريك، على سبيل المثال، يؤدي إلى النقرس والفشل الكلوي. بسبب عدم وجود الركيزة، لن يكون هناك منتج فائض. وهذا لا ينجح إلا في الحالات التي يمكن فيها الاستغناء عن أحدهما والآخر.
هناك عدة أسباب لزيادة نشاط الإنزيم. الأول هو طفرة جينية يمكن أن تكون خلقية أو مكتسبة تحت تأثير المطفرات. العامل الثاني هو وجود فائض من الفيتامينات أو العناصر الدقيقة في الماء أو الطعام، وهو أمر ضروري لعمل الإنزيم. فيتامين C الزائد، على سبيل المثال، من خلال زيادة نشاط إنزيمات تصنيع الكولاجين، يعطل آليات التئام الجروح.
نقص النشاط
يؤثر كل من زيادة وانخفاض نشاط الإنزيم سلبًا على عمل الجسم. في الحالة الثانية، من الممكن التوقف الكامل للنشاط. هذه الحالة تقلل بشكل كبير من معدل التفاعل الكيميائي للإنزيم. ونتيجة لذلك، فإن تراكم الركيزة يكمله نقص المنتج، الأمر الذي يؤدي إلى مضاعفات خطيرة. وعلى خلفية اضطرابات في وظائف الجسم الحيوية تتدهور الصحة وتتطور الأمراض وقد تحدث الوفاة. يؤدي تراكم الأمونيا أو نقص ATP إلى الوفاة. يتطور قلة القلة بسبب تراكم الفينيل ألانين. وينطبق المبدأ هنا أيضًا على أنه في حالة عدم وجود ركيزة إنزيمية، لن يحدث أي تراكم لركيزة التفاعل. الحالة التي لا تؤدي فيها إنزيمات الدم وظائفها يكون لها تأثير سيء على الجسم.

يتم النظر في عدة أسباب لنقص النشاط. الطفرة الجينية، الخلقية أو المكتسبة، هي الأولى. يمكن تصحيح الحالة باستخدام العلاج الجيني. يمكنك محاولة استبعاد ركائز الإنزيم المفقود من الطعام. في بعض الحالات قد يساعد هذا. العامل الثاني هو نقص الفيتامينات أو العناصر الدقيقة في الغذاء الضروري لعمل الإنزيم. الأسباب التالية هي ضعف تنشيط الفيتامين، ونقص الأحماض الأمينية، والحماض، وظهور مثبطات في الخلية، وتمسخ البروتين. يتناقص نشاط الإنزيم أيضًا مع انخفاض درجة حرارة الجسم. تؤثر بعض العوامل على وظيفة جميع أنواع الإنزيمات، بينما تؤثر عوامل أخرى على وظيفة أنواع معينة فقط.
الانزيمات الهاضمة
يستمتع الإنسان بعملية الأكل ويتجاهل أحيانًا حقيقة أن المهمة الرئيسية لعملية الهضم هي تحويل الطعام إلى مواد يمكن أن تصبح مصدرًا للطاقة ومواد بناء للجسم، ويتم امتصاصها في الأمعاء. إنزيمات البروتين تسهل هذه العملية. يتم إنتاج المواد الهضمية عن طريق أعضاء الجهاز الهضمي التي تشارك في عملية هضم الطعام. إن عمل الإنزيمات ضروري للحصول على الكربوهيدرات والدهون والأحماض الأمينية الضرورية من الطعام، والتي تشكل العناصر الغذائية والطاقة اللازمة للعمل الطبيعي للجسم.
من أجل تطبيع ضعف الهضم، يوصى بتناول المواد البروتينية الضرورية في نفس الوقت مع الوجبات. إذا كنت تتناول وجبة دسمة، يمكنك تناول 1-2 قرص بعد أو أثناء الوجبات. تبيع الصيدليات عددًا كبيرًا من مستحضرات الإنزيمات المختلفة التي تساعد على تحسين عمليات الهضم. يجب عليك تخزينها عند تناول نوع واحد من العناصر الغذائية. إذا كنت تعاني من مشاكل في مضغ الطعام أو بلعه، فيجب عليك تناول الإنزيمات مع الوجبات. قد تكون الأسباب المهمة لاستخدامها أيضًا أمراضًا مثل اعتلالات الإنزيمات المكتسبة والخلقية ومتلازمة القولون العصبي والتهاب الكبد والتهاب الأقنية الصفراوية والتهاب المرارة والتهاب البنكرياس والتهاب القولون والتهاب المعدة المزمن. يجب أن تؤخذ مستحضرات الإنزيم مع الأدوية التي تؤثر على عملية الهضم.

علم الأمراض الأنزيمية
هناك قسم كامل في الطب يبحث عن العلاقة بين المرض ونقص تخليق إنزيم معين. هذا هو مجال علم الإنزيمات - علم الأمراض الأنزيمية. ينبغي أيضًا مراعاة تخليق الإنزيم غير الكافي. على سبيل المثال، يتطور مرض بيلة الفينيل كيتون الوراثي على خلفية فقدان قدرة خلايا الكبد على تصنيع هذه المادة، مما يحفز تحويل الفينيل ألانين إلى التيروزين. أعراض هذا المرض هي الاضطرابات النفسية. ونظراً للتراكم التدريجي للمواد السامة في جسم المريض، تظهر علامات مزعجة مثل القيء، والقلق، وزيادة التهيج، وعدم الاهتمام بأي شيء، والتعب الشديد.
عند ولادة طفل، لا يظهر علم الأمراض. يمكن ملاحظة الأعراض الأولية بين عمر شهرين وستة أشهر. يتميز النصف الثاني من حياة الطفل بتأخر واضح في النمو العقلي. 60٪ من المرضى يصابون بالبلاهة، وأقل من 10٪ يقتصرون على درجة خفيفة من التخلف العقلي. إنزيمات الخلية لا تتعامل مع وظائفها، ولكن يمكن تصحيح ذلك. التشخيص في الوقت المناسب للتغيرات المرضية يمكن أن يوقف تطور المرض حتى سن البلوغ. يتكون العلاج من الحد من تناول الفينيل ألانين الغذائي.
الاستعدادات الانزيمية
الإجابة على سؤال ما هي الإنزيمات، يمكن الإشارة إلى تعريفين. الأول هو المحفزات البيوكيميائية، والثاني هو الأدوية التي تحتوي عليها. إنهم قادرون على تطبيع الحالة البيئية في المعدة والأمعاء، وضمان تقسيم المنتجات النهائية إلى جزيئات دقيقة، وتحسين عملية الامتصاص. كما أنها تمنع حدوث وتطور أمراض الجهاز الهضمي. وأشهر هذه الإنزيمات هو عقار Mezim Forte. أنه يحتوي على الليباز، الأميليز، والبروتياز، والتي تساعد على تقليل الألم في التهاب البنكرياس المزمن. تؤخذ الكبسولات كعلاج بديل لعدم كفاية إنتاج الإنزيمات الضرورية من البنكرياس.
وتستخدم هذه الأدوية في المقام الأول مع وجبات الطعام. يتم تحديد عدد الكبسولات أو الأقراص من قبل الطبيب، بناءً على الانتهاكات المحددة لآلية الامتصاص. ومن الأفضل تخزينها في الثلاجة. مع الاستخدام طويل الأمد للإنزيمات الهاضمة، لا يحدث الإدمان، وهذا لا يؤثر على عمل البنكرياس. عند اختيار الدواء، يجب عليك الانتباه إلى نسبة التاريخ والجودة والسعر. يوصى بتناول مستحضرات الإنزيم لأمراض الجهاز الهضمي المزمنة والإفراط في تناول الطعام ومشاكل المعدة الدورية وكذلك التسمم الغذائي. في أغلب الأحيان، يصف الأطباء الدواء اللوحي Mezim، الذي أثبت نفسه بشكل جيد في السوق المحلية ويحافظ على مكانته بثقة. هناك نظائر أخرى لهذا الدواء، لا تقل شهرة وأكثر بأسعار معقولة. على وجه الخصوص، يفضل الكثير من الناس أقراص Pakreatin أو Festal، التي لها نفس خصائص نظيراتها الأكثر تكلفة.
0تاريخ تطور علم الانزيمات
تعتمد جميع العمليات الحياتية على آلاف التفاعلات الكيميائية. وهي تحدث في الجسم دون استخدام درجات الحرارة والضغط المرتفعين، أي في ظل ظروف معتدلة. المواد التي تتأكسد في الخلايا البشرية والحيوانية تحترق بسرعة وكفاءة، مما يثري الجسم بالطاقة ومواد البناء. ولكن يمكن تخزين نفس المواد لسنوات سواء في شكل معلب (معزول عن الهواء) أو في الهواء بوجود الأكسجين. على سبيل المثال، اللحوم والأسماك المعلبة والحليب المبستر والسكر والحبوب لا تتحلل عند تخزينها لفترة طويلة. تعود القدرة على هضم الأطعمة بسرعة في الكائن الحي إلى وجود محفزات بيولوجية خاصة - الإنزيمات - في الخلايا.
الإنزيمات هي بروتينات محددة تشكل جزءًا من جميع خلايا وأنسجة الكائنات الحية، وتلعب دور المحفزات البيولوجية. لقد عرف الناس عن الإنزيمات لفترة طويلة. في بداية القرن الماضي في سانت بطرسبرغ، اكتشف K. S. Kirchhoff أن الشعير المنبت قادر على تحويل نشا السكاريد إلى مالتوز ثنائي السكاريد، كما قام مستخلص الخميرة بتفكيك سكر البنجر إلى سكريات أحادية - الجلوكوز والفركتوز. وكانت هذه الدراسات الأولى في علم الإنزيمات. والتطبيق العملي للعمليات الأنزيمية معروف منذ زمن سحيق. ويشمل ذلك تخمير العنب والعجين المخمر عند صنع الخبز وصنع الجبن وغير ذلك الكثير.
في الوقت الحاضر، في مختلف الكتب المدرسية والكتيبات والأدبيات العلمية، يتم استخدام مفهومين: "الإنزيمات" و "الإنزيمات". هذه الأسماء متطابقة. إنها تعني نفس الشيء - المحفزات البيولوجية. تتم ترجمة الكلمة الأولى باسم "الخميرة"، والثانية - "في الخميرة".
لفترة طويلة، لم يكن لديهم أي فكرة عما يحدث في الخميرة، وما هي القوة الموجودة فيها والتي تسبب تحلل المواد وتحولها إلى مواد أبسط. فقط بعد اختراع المجهر تم اكتشاف أن الخميرة عبارة عن مجموعة من عدد كبير من الكائنات الحية الدقيقة التي تستخدم السكر كمواد مغذية رئيسية لها. بمعنى آخر، كل خلية خميرة "محشوة" بالإنزيمات التي يمكنها تحلل السكر. ولكن في الوقت نفسه، كانت المحفزات البيولوجية الأخرى معروفة أيضًا، والتي لم تكن محاطة بخلية حية، ولكنها "تعيش" بحرية خارجها. على سبيل المثال، تم العثور عليها في عصائر المعدة ومستخلصات الخلايا. وفي هذا الصدد، تم التمييز في الماضي بين نوعين من المحفزات: كان يُعتقد أن الإنزيمات نفسها لا تنفصل عن الخلية ولا يمكنها العمل خارجها، أي أنها "منظمة". والمحفزات "غير المنظمة" التي يمكن أن تعمل خارج الخلية تسمى الإنزيمات. تم تفسير هذا التعارض بين الإنزيمات "الحية" والإنزيمات "غير الحية" بتأثير الحيويين، وصراع المادية والمثالية في العلوم الطبيعية. وانقسمت آراء العلماء. جادل مؤسس علم الأحياء الدقيقة L. Pasteur بأن نشاط الإنزيمات يتحدد بحياة الخلية. إذا تم تدمير الخلية، فإن عمل الإنزيم سوف يتوقف. طور الكيميائيون بقيادة ج. ليبج نظرية كيميائية بحتة للتخمير، تثبت أن نشاط الإنزيمات لا يعتمد على وجود الخلية.
في عام 1871، قام الطبيب الروسي إم إم مانسينا بتدمير خلايا الخميرة عن طريق فركها برمال النهر. احتفظت عصارة الخلية، المنفصلة عن حطام الخلية، بقدرتها على تخمير السكر. ظلت هذه التجربة البسيطة والمقنعة للطبيب الروسي دون الاهتمام الواجب في روسيا القيصرية. وبعد ربع قرن، حصل العالم الألماني إي. بوشنر على عصير خالي من الخلايا عن طريق ضغط الخميرة الحية تحت ضغط يصل إلى 5·10 6 باسكال. هذا العصير، مثل الخميرة الحية، يخمر السكر لتكوين الكحول وأول أكسيد الكربون (IV):
وضعت أعمال A. N. Lebedev حول دراسة خلايا الخميرة وأعمال علماء آخرين حداً للأفكار الحيوية في نظرية التحفيز البيولوجي، وبدأ استخدام مصطلحي "الإنزيم" و"الإنزيم" كمعادلين.
في الوقت الحاضر، علم الإنزيمات هو علم مستقل. تم عزل ودراسة حوالي 2000 إنزيم. ساهم العلماء السوفييت في هذا العلم - معاصرونا A. E. Braunstein، V. N. Orekhovich، V. A. Engelgard، A. A. Pokrovsky وآخرون.
الطبيعة الكيميائية للإنزيمات
وفي نهاية القرن الماضي، تم اقتراح أن الإنزيمات عبارة عن بروتينات أو بعض المواد التي تشبه البروتينات إلى حد كبير. إن فقدان نشاط الإنزيم عند التسخين يشبه إلى حد كبير عملية تمسخ البروتين الحراري. نطاق درجة الحرارة للتمسخ والتعطيل هو نفسه. كما هو معروف، يمكن أن يحدث تمسخ البروتين ليس فقط عن طريق التسخين، ولكن أيضًا عن طريق عمل الأحماض وأملاح المعادن الثقيلة والقلويات والإشعاع المطول بالأشعة فوق البنفسجية. نفس هذه العوامل الكيميائية والفيزيائية تؤدي إلى فقدان نشاط الإنزيم.
في المحاليل، تتصرف الإنزيمات، مثل البروتينات، بطريقة مماثلة تحت تأثير التيار الكهربائي: تتحرك الجزيئات نحو الكاثود أو الأنود. يؤدي التغير في تركيز أيونات الهيدروجين في محاليل البروتينات أو الإنزيمات إلى تراكم شحنة موجبة أو سالبة. وهذا يثبت الطبيعة المذبذبة للإنزيمات ويؤكد أيضًا طبيعتها البروتينية. دليل آخر على الطبيعة البروتينية للإنزيمات هو أنها لا تمر عبر أغشية نصف منفذة. وهذا يثبت أيضًا وزنها الجزيئي الكبير. ولكن إذا كانت الإنزيمات بروتينات، فلا ينبغي أن ينخفض \u200b\u200bنشاطها أثناء الجفاف. وتؤكد التجارب صحة هذا الافتراض.
تم إجراء تجربة مثيرة للاهتمام في مختبر آي بي بافلوف. عند تلقي عصير المعدة عن طريق ناسور في الكلاب، اكتشف الموظفون أنه كلما زاد البروتين في العصير، زاد نشاطه، أي أن البروتين المكتشف هو إنزيم عصير المعدة.
وهكذا، فإن ظواهر تمسخ الطبيعة والتنقل في المجال الكهربائي، والطبيعة المذبذبة للجزيئات، والطبيعة الجزيئية العالية، والقدرة على الترسيب من المحلول تحت تأثير عوامل إزالة الماء (الأسيتون أو الكحول) تثبت الطبيعة البروتينية للجزيئات. الانزيمات.
حتى الآن، تم إثبات هذه الحقيقة من خلال العديد من الطرق الفيزيائية أو الكيميائية أو البيولوجية الأكثر دقة.
نحن نعلم بالفعل أن البروتينات يمكن أن تكون مختلفة جدًا في التركيب، وقبل كل شيء، يمكن أن تكون بسيطة أو معقدة. ما هي البروتينات التي تنتمي إليها الإنزيمات المعروفة حاليًا؟
لقد وجد علماء من مختلف البلدان أن العديد من الإنزيمات عبارة عن بروتينات بسيطة. وهذا يعني أنه أثناء التحلل المائي، تتحلل جزيئات هذه الإنزيمات فقط إلى الأحماض الأمينية. ليس من الممكن اكتشاف أي شيء آخر غير الأحماض الأمينية في هيدروليزات مثل هذه الإنزيمات البروتينية. تشمل الإنزيمات البسيطة البيبسين - وهو إنزيم يهضم البروتينات في المعدة ويوجد في عصير المعدة، والتربسين - وهو إنزيم موجود في عصير البنكرياس، والغراء - وهو إنزيم نباتي، واليورياز، وما إلى ذلك.
تشمل الإنزيمات المعقدة، بالإضافة إلى الأحماض الأمينية، مواد ذات طبيعة غير بروتينية. على سبيل المثال، تحتوي إنزيمات الأكسدة والاختزال الموجودة في الميتوكوندريا، بالإضافة إلى الجزء البروتيني، على ذرات الحديد والنحاس ومجموعات أخرى قابلة للحرارة. يمكن أيضًا أن يكون الجزء غير البروتيني من الإنزيم عبارة عن مواد أكثر تعقيدًا: الفيتامينات والنيوكليوتيدات (مونومرات الأحماض النووية) والنيوكليوتيدات التي تحتوي على ثلاث بقايا فوسفور، وما إلى ذلك. ومن المتفق عليه تسمية الجزء غير البروتيني في هذه البروتينات المعقدة بالإنزيم المساعد، والجزء البروتيني هو أنزيم مساعد.
الفرق بين الانزيمات والمحفزات غير البيولوجية
تناقش الكتب المدرسية وأدلة الكيمياء عمل المحفزات بالتفصيل وتعطي فكرة عن حاجز الطاقة وطاقة التنشيط. دعونا نتذكر فقط أن دور المحفزات يكمن في قدرتها على تنشيط جزيئات المواد التي تدخل في التفاعل. وهذا يؤدي إلى انخفاض في طاقة التنشيط. لا يحدث التفاعل في مرحلة واحدة، بل على عدة مراحل مع تكوين مركبات وسيطة. لا تغير المحفزات اتجاه التفاعل، ولكنها تؤثر فقط على معدل الوصول إلى حالة التوازن الكيميائي. يستخدم التفاعل المحفز دائمًا طاقة أقل مقارنة بالتفاعل غير المحفز. أثناء التفاعل، يغير الإنزيم عبوته، و"يضغط"، وفي نهاية التفاعل، يأخذ بنيته الأصلية ويعود إلى شكله الأصلي.
الإنزيمات هي نفس المحفزات. وتتميز بجميع قوانين الحفز. لكن الإنزيمات عبارة عن بروتينات، وهذا يمنحها خصائص خاصة. ما هو القاسم المشترك بين الإنزيمات ومحفزاتنا المعتادة، مثل البلاتين وأكسيد الفاناديوم (V) وغيرها من مسرعات التفاعل غير العضوية، وما الذي يجعلها مختلفة؟
ويمكن استخدام نفس المحفز غير العضوي في صناعات مختلفة. ويحفز الإنزيم تفاعلًا واحدًا فقط أو نوعًا واحدًا من التفاعل، أي أنه أكثر تحديدًا من المحفز غير العضوي.
تؤثر درجة الحرارة دائمًا على معدلات التفاعلات الكيميائية. تحدث معظم التفاعلات مع المحفزات غير العضوية عند درجات حرارة عالية جدًا. مع زيادة درجة الحرارة، عادة ما يزيد معدل التفاعل (الشكل 1). بالنسبة للتفاعلات الأنزيمية، تقتصر هذه الزيادة على درجة حرارة معينة (درجة الحرارة المثلى). تؤدي الزيادة الإضافية في درجة الحرارة إلى تغيرات في جزيء الإنزيم، مما يؤدي إلى انخفاض معدل التفاعل (الشكل 1). لكن بعض الإنزيمات، على سبيل المثال إنزيمات الكائنات الحية الدقيقة الموجودة في مياه الينابيع الساخنة الطبيعية، لا تتحمل درجات حرارة قريبة من درجة غليان الماء فحسب، بل تظهر أيضًا أقصى نشاط لها. بالنسبة لمعظم الإنزيمات، تكون درجة الحرارة المثلى قريبة من 35-45 درجة مئوية. في درجات الحرارة المرتفعة، ينخفض \u200b\u200bنشاطها، ثم يحدث تمسخ حراري كامل.

أرز. 1. تأثير درجة الحرارة على نشاط الإنزيم: 1 - زيادة معدل التفاعل، 2 - انخفاض معدل التفاعل.
تُظهر العديد من المحفزات غير العضوية أقصى قدر من الكفاءة في البيئات شديدة الحموضة أو القلوية. في المقابل، تنشط الإنزيمات فقط عند القيم الفسيولوجية لحموضة المحلول، فقط عند تركيز أيونات الهيدروجين المتوافق مع الحياة والأداء الطبيعي للخلية أو العضو أو النظام.
تحدث التفاعلات التي تتضمن محفزات غير عضوية عادة عند ضغوط عالية، بينما تعمل الإنزيمات عند الضغط العادي (الجوي).
والفرق الأكثر إثارة للدهشة بين الإنزيم والمحفزات الأخرى هو أن معدل التفاعلات المحفزة بواسطة الإنزيمات أعلى بعشرات الآلاف وأحيانا ملايين المرات مما يمكن تحقيقه بمشاركة المحفزات غير العضوية.
بيروكسيد الهيدروجين المعروف، والذي يستخدم في الحياة اليومية كمبيض ومطهر، يتحلل ببطء بدون محفزات:
![]()
في وجود محفز غير عضوي (أملاح الحديد)، يتم هذا التفاعل بشكل أسرع إلى حد ما. والكاتالاز (إنزيم موجود في جميع الخلايا تقريبًا) يدمر بيروكسيد الهيدروجين بسرعة لا يمكن تصورها: حيث يقوم جزيء الكاتلاز الواحد بتكسير أكثر من 5 ملايين جزيء من H 2 O 2 في دقيقة واحدة.
يتم تفسير التوزيع العالمي للكاتالاز في خلايا جميع أعضاء الكائنات الهوائية والنشاط العالي لهذا الإنزيم من خلال حقيقة أن بيروكسيد الهيدروجين هو سم خلوي قوي. يتم إنتاجه في الخلايا كمنتج ثانوي للعديد من التفاعلات، ولكن إنزيم الكاتالاز في حالة تأهب، والذي يقوم على الفور بتفكيك بيروكسيد الهيدروجين إلى أكسجين وماء غير ضارين.
موقع الانزيم النشط
الخطوة الإلزامية في التفاعل المحفز هي تفاعل الإنزيم مع المادة التي يحفز تحولها - مع الركيزة: يتم تشكيل مجمع الإنزيم والركيزة. في المثال أعلاه، بيروكسيد الهيدروجين هو الركيزة لعمل الكاتلاز.
اتضح أنه في التفاعلات الأنزيمية، يكون جزيء الركيزة أصغر بعدة مرات من جزيء بروتين الإنزيم. وبالتالي، لا يمكن للركيزة الاتصال بجزيء الإنزيم الضخم بأكمله، ولكن فقط جزء صغير منه أو حتى مجموعة منفصلة، ذرة. ولتأكيد هذا الافتراض، قام العلماء بفصل واحد أو أكثر من الأحماض الأمينية من الإنزيم، ولم يكن لهذا أي تأثير تقريبًا على معدل التفاعل المحفز. لكن انقسام بعض الأحماض الأمينية أو المجموعات المحددة أدى إلى فقدان كامل للخصائص التحفيزية للإنزيم. وهكذا تشكلت فكرة المركز النشط للإنزيم.
المركز النشط هو جزء من جزيء البروتين الذي يضمن اتصال الإنزيم بالركيزة ويجعل من الممكن إجراء مزيد من التحولات للركيزة. تمت دراسة بعض المواقع النشطة للإنزيمات المختلفة. وهي إما مجموعة وظيفية (على سبيل المثال، مجموعة OH من السيرين) أو حمض أميني منفصل. في بعض الأحيان تكون هناك حاجة إلى عدة أحماض أمينية بترتيب معين لتوفير تأثير تحفيزي.
يتكون المركز النشط من أقسام ذات وظائف مختلفة. توفر بعض مناطق المركز النشط التصاقًا بالركيزة واتصالًا قويًا بها. لذلك، يطلق عليها مناطق المرساة أو مناطق الاتصال. يقوم البعض الآخر بأداء الوظيفة التحفيزية الفعلية، حيث يقوم بتنشيط الركيزة - المواقع الحفزية. يساعد هذا التقسيم الشرطي للمركز النشط على تمثيل آلية التفاعل التحفيزي بشكل أكثر دقة.
كما تمت دراسة نوع الرابطة الكيميائية في مجمعات الإنزيمات والركائز. يتم تثبيت المادة (الركيزة) على الإنزيم بمشاركة أنواع مختلفة من الروابط: جسور الهيدروجين، والروابط الأيونية، والتساهمية، والروابط بين المانح والمستقبل، وقوى تماسك فان دير فالس.
يؤدي تشوه جزيئات الإنزيم في المحلول إلى ظهور أيزومراته التي تختلف في البنية الثلاثية. بمعنى آخر، يوجه الإنزيم مجموعاته الوظيفية الموجودة في المركز النشط بحيث يظهر أكبر نشاط تحفيزي. لكن جزيئات الركيزة يمكن أيضًا أن تتشوه و"تتوتر" عند التفاعل مع الإنزيم. تختلف هذه الأفكار الحديثة حول تفاعل الإنزيم مع الركيزة عن النظرية السائدة سابقًا لـ E. Fischer، الذي اعتقد أن جزيء الركيزة يتوافق تمامًا مع المركز النشط للإنزيم ويتناسب معه مثل مفتاح القفل.
خصائص الانزيمات
الخاصية الأكثر أهمية للإنزيمات هي التسارع التفضيلي لأحد التفاعلات العديدة الممكنة نظريًا. وهذا يسمح للركائز باختيار سلاسل التحولات الأكثر فائدة للكائن الحي من عدد من المسارات المحتملة.
اعتمادًا على الظروف، تكون الإنزيمات قادرة على تحفيز التفاعلات الأمامية والعكسية. على سبيل المثال، يتم تحويل حمض البيروفيك تحت تأثير إنزيم هيدروجيناز اللاكتات إلى منتج التخمير النهائي - حمض اللاكتيك. يقوم نفس الإنزيم أيضًا بتحفيز التفاعل العكسي، وقد حصل على اسمه ليس من التفاعل المباشر، ولكن من التفاعل العكسي. يحدث كلا التفاعلين في الجسم في ظل ظروف مختلفة:
هذه الخاصية للإنزيمات لها أهمية عملية كبيرة.
خاصية أخرى مهمة للإنزيمات هي القابلية للحرارة، أي الحساسية العالية للتغيرات في درجات الحرارة. لقد قلنا بالفعل أن الإنزيمات عبارة عن بروتينات. بالنسبة لمعظمها، تؤدي درجات الحرارة فوق 70 درجة مئوية إلى تمسخ الطبيعة وفقدان النشاط. ومن المعروف من مقرر الكيمياء أن زيادة درجة الحرارة بمقدار 10 درجات مئوية تؤدي إلى زيادة معدل التفاعل بمقدار 2-3 مرات، وهو أمر نموذجي أيضًا للتفاعلات الأنزيمية، ولكن إلى حد معين. عند درجات حرارة قريبة من 0 درجة مئوية، يتباطأ معدل التفاعلات الأنزيمية إلى الحد الأدنى. وتستخدم هذه الخاصية على نطاق واسع في مختلف قطاعات الاقتصاد الوطني، وخاصة في الزراعة والطب. على سبيل المثال، جميع الطرق الموجودة حاليًا للحفاظ على الكلية قبل زراعتها للمريض تشمل تبريد العضو من أجل تقليل شدة التفاعلات الكيميائية الحيوية وإطالة عمر الكلية قبل زراعتها للإنسان. وقد حافظت هذه التقنية على صحة وأنقذت حياة عشرات الآلاف من الأشخاص حول العالم.

أرز. 2. تأثير الرقم الهيدروجيني على نشاط الانزيم.
من أهم خصائص بروتينات الإنزيمات هي حساسيتها لتفاعل البيئة وتركيز أيونات الهيدروجين أو أيونات الهيدروكسيد. تنشط الإنزيمات فقط في نطاق ضيق من الحموضة أو القلوية (pH). على سبيل المثال، يصل نشاط البيبسين في تجويف المعدة إلى الحد الأقصى عند درجة حموضة تبلغ حوالي 1 -1.5. يؤدي انخفاض الحموضة إلى اضطراب عميق في الجهاز الهضمي وقلة هضم الطعام ومضاعفات خطيرة. تعلم من مقرر علم الأحياء الخاص بك أن عملية الهضم تبدأ في تجويف الفم، حيث يوجد الأميليز اللعابي. قيمة الرقم الهيدروجيني الأمثل لها هي 6.8-7.4. تتميز الإنزيمات المختلفة في الجهاز الهضمي باختلافات كبيرة في الرقم الهيدروجيني الأمثل (الشكل 2). يؤدي التغير في رد فعل البيئة إلى تغير في الشحنات الموجودة على جزيء الإنزيم أو حتى في مركزه النشط، مما يسبب نقصان النشاط أو فقدانه بالكامل.
الخاصية المهمة التالية هي خصوصية عمل الإنزيم. يقوم الكاتالاز بتكسير بيروكسيد الهيدروجين فقط، واليورياز فقط اليوريا H 2 N-CO-NH 2، أي أن الإنزيم يحفز تحويل ركيزة واحدة فقط، فهو "يتعرف" فقط على جزيئه. تعتبر هذه الخصوصية مطلقة. إذا كان الإنزيم يحفز تحول عدة ركائز لها نفس المجموعة الوظيفية، فإن هذه الخصوصية تسمى خصوصية المجموعة. على سبيل المثال، يحفز الفوسفاتيز انقسام بقايا حمض الفوسفوريك:

أحد أنواع الخصوصية هو حساسية الإنزيم لأيزومر واحد فقط - الخصوصية الكيميائية المجسمة.
تؤثر الإنزيمات على معدل تحول المواد المختلفة. لكن بعض المواد تؤثر أيضًا على الإنزيمات، وتغير نشاطها بشكل كبير. المواد التي تزيد من نشاط الإنزيمات وتنشطها تسمى منشطات، والمواد التي تثبطها تسمى مثبطات. يمكن أن تؤثر المثبطات على الإنزيم بشكل لا رجعة فيه. بعد عملهم، لا يمكن للإنزيم أبدًا تحفيز تفاعله، حيث سيتم تغيير بنيته بشكل كبير. هذه هي الطريقة التي تعمل بها أملاح المعادن الثقيلة والأحماض والقلويات على الإنزيم. يمكن إزالة المثبط العكسي من المحلول ويصبح الإنزيم نشطًا مرة أخرى. غالبًا ما يحدث هذا التثبيط العكسي بطريقة تنافسية، أي أن الركيزة ومثبط مماثل يتنافسان على المركز النشط. يمكن إزالة هذا التثبيط عن طريق زيادة تركيز الركيزة وإزاحة المانع من الموقع النشط مع الركيزة.
من الخصائص المهمة للعديد من الإنزيمات أنها توجد في الأنسجة والخلايا بشكل غير نشط (الشكل 3). يسمى الشكل غير النشط من الإنزيمات بالإنزيم. الأمثلة الكلاسيكية على ذلك هي الأشكال غير النشطة من البيبسين أو التربسين. إن وجود أشكال غير نشطة من الإنزيمات له أهمية بيولوجية كبيرة. إذا تم إنتاج البيبسين أو التربسين على الفور في شكل نشط، فإن هذا من شأنه أن يؤدي، على سبيل المثال، إلى حقيقة أن البيبسين "يهضم" جدار المعدة، أي أن المعدة "تهضم" نفسها. لا يحدث هذا لأن البيبسين أو التربسين يصبحان نشطين فقط بعد دخولهما إلى تجويف المعدة أو الأمعاء الدقيقة: حيث يتم فصل العديد من الأحماض الأمينية عن البيبسين تحت تأثير حمض الهيدروكلوريك الموجود في عصير المعدة، ويكتسب القدرة على تحطيم البروتينات. والمعدة نفسها محمية الآن من عمل الإنزيمات الهضمية بواسطة الغشاء المخاطي المبطن لتجويفها.

أرز. 3 مخطط تحويل التربسينوجين إلى التربسين النشط: أ - التربسينوجين. ب - التربسين. 1 - مكان انفصال الببتيد. 2 - روابط هيدروجينية. 3 - جسر ثاني كبريتيد. 4- انقسام الببتيد عند التنشيط.
تحدث عملية تنشيط الإنزيم، كقاعدة عامة، بإحدى الطرق الأربع الموضحة في الشكل 4. في الحالة الأولى، "يفتح" انقسام الببتيد من الإنزيم غير النشط المركز النشط ويجعل الإنزيم نشطًا.

أرز. 4 مسارات لتنشيط الإنزيم (يُشار إلى جزيء الركيزة بالتظليل):
1 - انقسام جزء صغير (الببتيد) من الإنزيم المساعد وتحويل الإنزيم غير النشط إلى إنزيم نشط. 2 - تكوين روابط ثاني كبريتيد من مجموعات SH، وتحرير المركز النشط؛ 3- تكوين مركب بروتيني مع المعادن، تنشيط الإنزيم: 4- تكوين مركب إنزيمي مع بعض المواد (وهذا يحرر الوصول إلى المركز النشط).
الطريقة الثانية هي تشكيل جسور ثاني كبريتيد S-S، مما يجعل الموقع النشط سهل الوصول إليه. وفي الحالة الثالثة، يؤدي وجود المعدن إلى تنشيط إنزيم لا يمكنه العمل إلا مع هذا المعدن. يوضح المسار الرابع التنشيط بواسطة مادة ما ترتبط بالمنطقة المحيطية لجزيء البروتين وتشوه الإنزيم بطريقة تسهل وصول الركيزة إلى المركز النشط.
في السنوات الاخيرةتم اكتشاف طريقة أخرى لتنظيم نشاط الإنزيم، وتبين أن إنزيمًا واحدًا، على سبيل المثال هيدروجيناز اللاكتات، يمكن أن يكون في عدة أشكال جزيئية تختلف عن بعضها البعض، على الرغم من أنها جميعها تحفز نفس التفاعل. توجد جزيئات إنزيمية مختلفة في التركيب، والتي تحفز نفس التفاعل، حتى داخل نفس الخلية. يطلق عليها اسم النظائر الإنزيمية، أي أيزومرات الإنزيم. يحتوي نازعة هيدروجين اللاكتات المذكورة بالفعل على خمسة أنزيمات مختلفة. ما هو دور الأشكال المتعددة للإنزيم الواحد؟ على ما يبدو، فإن الجسم "يؤمن" بعض التفاعلات المهمة بشكل خاص عندما، عندما تتغير الظروف في الخلية، يعمل الشكل الأول أو الآخر من الإنزيم المتماثل، ويوفر السرعة والاتجاه اللازمين للعملية.
وخاصية أخرى مهمة للإنزيمات. في كثير من الأحيان لا تعمل في الخلية بشكل منفصل عن بعضها البعض، ولكن يتم تنظيمها في شكل مجمعات - أنظمة إنزيمية (الشكل 5): منتج التفاعل السابق هو الركيزة للتفاعل اللاحق. هذه الأنظمة مدمجة في أغشية الخلايا وتوفر أكسدة مستهدفة سريعة للمادة، و"تنقلها" من إنزيم إلى إنزيم. تحدث العمليات الاصطناعية في الخلية في أنظمة إنزيمية مماثلة.
تصنيف الانزيمات
نطاق القضايا التي يدرسها علم الإنزيمات واسع. عدد الإنزيمات المستخدمة في الرعاية الصحية والزراعة وعلم الأحياء الدقيقة وغيرها من فروع العلوم والممارسة كبير. أدى هذا إلى صعوبة في وصف التفاعلات الأنزيمية، حيث يمكن تسمية نفس الإنزيم إما عن طريق الركيزة، أو عن طريق نوع التفاعلات المحفزة، أو عن طريق مصطلح قديم أصبح راسخًا في الأدبيات: على سبيل المثال، البيبسين، التربسين، الكاتلاز.

أرز. 5. الهيكل المقترح لمجمع متعدد الإنزيمات الذي يقوم بتصنيع الأحماض الدهنية (سبع وحدات فرعية من الإنزيم مسؤولة عن سبعة تفاعلات كيميائية).
ولذلك، في عام 1961، وافق المؤتمر الدولي للكيمياء الحيوية في موسكو على تصنيف الإنزيمات، والذي يعتمد على نوع التفاعل المحفز بواسطة إنزيم معين. يجب أن يحتوي اسم الإنزيم على اسم الركيزة، أي المركب الذي يعمل عليه الإنزيم، والنهاية -ase. على سبيل المثال، يحفز الأرجيناز التحلل المائي للأرجينين.
ووفقا لهذا المبدأ، تم تقسيم جميع الإنزيمات إلى ستة فئات.
1. إنزيمات الأكسدة هي إنزيمات تحفز تفاعلات الأكسدة والاختزال، على سبيل المثال الكاتلاز:
![]()
2. إنزيمات النقل - الإنزيمات التي تحفز نقل الذرات أو الجذور، على سبيل المثال، إنزيمات نقل الميثيل التي تنقل مجموعة CH3:
3. الهيدرولاز - الإنزيمات التي تحطم الروابط داخل الجزيئات عن طريق ربط جزيئات الماء، على سبيل المثال الفوسفاتيز:

4. الليازات هي إنزيمات تشق مجموعة أو أخرى من الركيزة دون إضافة الماء، بطريقة غير متحللة، على سبيل المثال، انقسام مجموعة الكربوكسيل بواسطة ديكاربوكسيلاز:

5. الأيزومرات هي إنزيمات تحفز تحويل أيزومر إلى آخر:
جلوكوز-6-فوسفات-›جلوكوز-1-فوسفات
6. الإنزيمات التي تحفز تفاعلات التخليق، على سبيل المثال تخليق الببتيدات من الأحماض الأمينية. تسمى هذه الفئة من الإنزيمات Synthetases.
تم اقتراح تشفير كل إنزيم برمز مكون من أربعة أرقام، حيث يشير الأول منهم إلى رقم الفئة، والثلاثة المتبقية تصف بمزيد من التفصيل خصائص الإنزيم وفئته الفرعية ورقم الكتالوج الفردي.
كمثال لتصنيف الإنزيمات، نعطي الكود المكون من أربعة أرقام المخصص للبيبسين - 3.4.4 لتر. يشير الرقم 3 إلى فئة الإنزيم - هيدرولاز. الرقم التالي 4 يشفر فئة فرعية من هيدرات الببتيد، أي تلك الإنزيمات التي تحلل روابط الببتيد. يشير الرقم 4 الآخر إلى فئة فرعية تسمى هيدرولاز الببتيد الببتيد. تتضمن هذه الفئة الفرعية بالفعل الانزيمات الفرديةوالأول فيه هو البيبسين الذي له الرقم التسلسلي 1.
هذه هي الطريقة التي يظهر بها الكود الخاص به - 3.4.4.1. تظهر نقاط عمل إنزيمات فئة الهيدرولاز في الشكل 6.

أرز. 6. انقسام الروابط الببتيدية بواسطة الإنزيمات المحللة للبروتين المختلفة.
عمل الانزيمات
عادة، يتم عزل الإنزيمات من كائنات مختلفة ذات أصل حيواني أو نباتي أو ميكروبى ويتم دراسة عملها خارج الخلية والكائن الحي. وهذه الدراسات مهمة جدًا لفهم آلية عمل الإنزيمات ودراسة تركيبها وخصائص التفاعلات التي تحفزها. لكن المعلومات التي يتم الحصول عليها بهذه الطريقة لا يمكن نقلها ميكانيكيا مباشرة إلى نشاط الإنزيمات في الخلية الحية. خارج الخلية، من الصعب إعادة إنتاج الظروف التي يعمل فيها الإنزيم، على سبيل المثال في الميتوكوندريا أو الليزوزوم. بالإضافة إلى ذلك، ليس من المعروف دائمًا عدد جزيئات الإنزيم المتاحة المشاركة في التفاعل - كلها أو بعضها فقط.
يتبين دائمًا أن الخلية تحتوي على إنزيم أو آخر، يتجاوز محتواه عدة عشرات المرات الكمية المطلوبة لعملية التمثيل الغذائي الطبيعي. تختلف شدة عملية التمثيل الغذائي في فترات مختلفة من حياة الخلية، ولكن تحتوي على إنزيمات أكثر بكثير مما يتطلبه الحد الأقصى لمستوى التمثيل الغذائي. على سبيل المثال، تحتوي خلايا عضلة القلب على كمية كبيرة من السيتوكروم ج بحيث يمكنها إجراء عملية أكسدة أكبر 20 مرة من الحد الأقصى لاستهلاك الأكسجين في عضلة القلب. تم اكتشاف المواد لاحقًا التي يمكنها "إيقاف" بعض جزيئات الإنزيم. هذه هي ما يسمى العوامل المثبطة. لفهم آلية عمل الإنزيمات، من المهم أيضًا ألا تكون في محلول في الخلية فحسب، بل تكون مدمجة في بنية الخلية. من المعروف الآن ما هي الإنزيمات المبنية في الغشاء الخارجي للميتوكوندريا، والتي يتم بناؤها في الغشاء الداخلي، والتي ترتبط بالنواة والجسيمات الحالة وغيرها من الهياكل تحت الخلوية.
إن الموقع "الإقليمي" القريب للإنزيم الذي يحفز التفاعل الأول للإنزيمات التي تحفز التفاعلات الثانية والثالثة واللاحقة يؤثر بشكل كبير على النتيجة الإجمالية لعملها. على سبيل المثال، يتم بناء سلسلة من الإنزيمات التي تنقل الإلكترونات إلى الأكسجين في الميتوكوندريا - نظام السيتوكروم. فهو يحفز أكسدة الركائز لإنتاج الطاقة، والتي تتراكم في ATP.
عندما تتم إزالة الإنزيمات من الخلية، يتم تعطيل تماسك عملها المشترك. ولذلك يحاولون دراسة عمل الإنزيمات دون تدمير الهياكل التي تُبنى فيها جزيئاتها. على سبيل المثال، إذا تم الاحتفاظ بقسم من الأنسجة في محلول ركيزة ثم معالجته بكاشف ينتج مركبًا ملونًا مع منتجات التفاعل، فإن المناطق الملونة للخلية ستكون مرئية بوضوح في المجهر: في هذه المناطق يتم إنزيم الإنزيم التي تم هضمها الركيزة كانت موضعية (تقع). وبالتالي، تم تحديد خلايا المعدة التي تحتوي على البيبسينوجين، والتي يتم الحصول على إنزيم البيبسين منها.
يتم الآن استخدام طريقة أخرى على نطاق واسع لتحديد توطين الإنزيمات - الطرد المركزي للفصل. للقيام بذلك، يتم سحق الأنسجة قيد الدراسة (على سبيل المثال، قطع من كبد حيوانات المختبر)، ثم يتم تحضير عجينة منها في محلول السكروز. ينقل الخليط إلى أنابيب اختبار ويدور بسرعات عالية في أجهزة الطرد المركزي. يتم توزيع العناصر الخلوية المختلفة، حسب كتلتها وحجمها، في محلول سكروز كثيف أثناء الدوران تقريبًا على النحو التالي:

للحصول على نوى ثقيلة، يلزم تسارع صغير نسبيًا (دورات أقل). بعد فصل النوى، وزيادة عدد الثورات، يتم ترسيب الميتوكوندريا والميكروسومات على التوالي ويتم الحصول على السيتوبلازم. الآن يمكن دراسة نشاط الإنزيمات في كل جزء من الأجزاء المعزولة. اتضح أن معظم الإنزيمات المعروفة تتمركز في الغالب في جزء أو آخر. على سبيل المثال، يتمركز إنزيم ألدولاز في السيتوبلازم، والإنزيم الذي يؤكسد حمض الكابرويك يوجد في الغالب في الميتوكوندريا.
في حالة تلف الغشاء الذي تندمج فيه الإنزيمات، لا تحدث عمليات معقدة مترابطة، أي أن كل إنزيم لا يمكنه العمل إلا من تلقاء نفسه.
تحتوي الخلايا النباتية والميكروبية، مثل الخلايا الحيوانية، على أجزاء خلوية متشابهة جدًا. على سبيل المثال، تشبه البلاستيدات النباتية الميتوكوندريا في مجموعة الإنزيمات الخاصة بها. تحتوي الكائنات الحية الدقيقة على حبيبات تشبه الريبوسومات وتحتوي أيضًا على كميات كبيرة من حمض الريبونوكلييك. الإنزيمات الموجودة في الخلايا الحيوانية والنباتية والميكروبية لها تأثيرات مماثلة. على سبيل المثال، يسهل الهيالورونيداز دخول الميكروبات إلى الجسم عن طريق تعزيز تدمير جدار الخلية. تم العثور على نفس الإنزيم في أنسجة مختلفة من الكائنات الحيوانية.
تحضير واستخدام الانزيمات
توجد الإنزيمات في جميع أنسجة الحيوانات والنباتات. ومع ذلك، فإن كمية الإنزيم نفسه في الأنسجة المختلفة وقوة ارتباط الإنزيم بالأنسجة ليسا متماثلين. لذلك، في الممارسة العملية، لا يكون الحصول عليه مبررا دائما.
يمكن أن يكون مصدر الإنزيمات هو العصائر الهضمية للإنسان والحيوان. تحتوي العصائر على عدد قليل نسبياً من الشوائب الأجنبية والعناصر الخلوية والمكونات الأخرى التي يجب التخلص منها عند الحصول على مستحضر نقي. هذه محاليل إنزيمية نقية تقريبًا.
من الصعب الحصول على الإنزيم من الأنسجة. للقيام بذلك، يتم سحق الأنسجة، وتدمير الهياكل الخلوية عن طريق فرك الأنسجة المسحوقة بالرمل، أو معالجتها بالموجات فوق الصوتية. في هذه الحالة، "تسقط" الإنزيمات من الخلايا والهياكل الغشائية. يتم الآن تنظيفها وفصلها عن بعضها البعض. للتنقية، يتم استخدام القدرة المختلفة للإنزيمات على الأعمدة الكروماتوغرافية، وحركتها غير المتكافئة في مجال كهربائي، وترسيبها بالكحول والأملاح والأسيتون وغيرها من الطرق. نظرًا لأن معظم الإنزيمات مرتبطة بالنواة أو الميتوكوندريا أو الريبوسومات أو غيرها من الهياكل التحت خلوية، يتم عزل هذا الجزء أولاً عن طريق الطرد المركزي، ثم يتم استخلاص الإنزيم منه
إن تطوير طرق التنقية الجديدة جعل من الممكن الحصول على عدد من الإنزيمات البلورية في شكل نقي للغاية، والتي يمكن تخزينها لسنوات.
ومن المستحيل الآن تحديد متى استخدم الناس هذا الإنزيم لأول مرة، لكن يمكننا القول بثقة كبيرة أنه كان إنزيمًا من أصل نباتي. لقد اهتم الناس منذ فترة طويلة بفائدة هذا النبات أو ذاك ليس فقط كمنتج غذائي. على سبيل المثال، استخدم سكان جزر الأنتيل منذ فترة طويلة عصير شجرة البطيخ لعلاج القرحة والأمراض الجلدية الأخرى.
دعونا نفكر بمزيد من التفصيل في ميزات إنتاج وتطبيق الإنزيمات باستخدام مثال أحد المحفزات الحيوية النباتية المعروفة الآن - غراء. يوجد هذا الإنزيم في النسغ اللبني في جميع أجزاء شجرة الفاكهة الاستوائية البابايا - وهي عشبة عملاقة تشبه الأشجار يصل ارتفاعها إلى 10 أمتار، وتشبه ثمارها البطيخ في الشكل والطعم وتحتوي على كميات كبيرة من إنزيم الباباين. مرة أخرى في بداية القرن السادس عشر. اكتشف الملاحون الإسبان هذا النبات في الظروف الطبيعية في أمريكا الوسطى. ثم تم إحضاره إلى الهند، ومن هناك إلى جميع البلدان الاستوائية. فاسكو دا جاما، الذي رأى البابايا في الهند، أطلق عليها اسم شجرة الحياة الذهبية، وقال ماركو بولو إن البابايا هي "بطيخة تسلقت شجرة". عرف البحارة أن ثمار الشجرة تنقذهم من مرض الاسقربوط والدوسنتاريا.
في بلدنا، تنمو البابايا على ساحل البحر الأسود في القوقاز، في الحديقة النباتية التابعة للأكاديمية الروسية للعلوم في دفيئات خاصة. يتم الحصول على المادة الخام للإنزيم - عصير الحليب - من قطع قشر الفاكهة. ثم يتم تجفيف العصير في المختبر في خزانات التجفيف الفراغي عند درجات حرارة منخفضة (لا تزيد عن 80 درجة مئوية). يتم طحن المنتج المجفف وتخزينه في عبوة معقمة مغطاة بالبارافين. هذا بالفعل دواء نشط إلى حد ما. يمكن تقييم نشاطه الأنزيمي من خلال كمية بروتين الكازين المتحلل لكل وحدة زمنية. يُعتقد أن إحدى الوحدات البيولوجية لنشاط الغراء هي كمية الإنزيم التي تكون كافية عند إدخالها إلى الدم لتسبب ظهور أعراض "تدلى الأذنين" في أرنب يزن 1 كجم. تحدث هذه الظاهرة لأن الغراء يبدأ في التأثير على خيوط بروتين الكولاجين الموجودة في آذان الأرنب.
يحتوي البابين على مجموعة كاملة من الخصائص: محلل للبروتين، مضاد للالتهابات، مضاد للتخثر (يمنع تخثر الدم)، الجفاف، مسكن ومبيد للجراثيم. إنه يكسر البروتينات إلى عديدات الببتيد والأحماض الأمينية. علاوة على ذلك، فإن هذا الانقسام يكون أعمق من عمل الإنزيمات الأخرى ذات الأصل الحيواني والبكتيري. الميزة الخاصة للغراء هي قدرته على أن يكون نشطًا في نطاق واسع من الأس الهيدروجيني وفي تقلبات كبيرة في درجات الحرارة، وهو أمر مهم ومريح بشكل خاص للاستخدام الواسع النطاق لهذا الإنزيم. وإذا أخذنا في الاعتبار أيضًا أنه للحصول على إنزيمات مشابهة في عملها للغراء (الببسين، التربسين، الليديز)، فإن الدم أو الكبد أو العضلات أو الأنسجة الحيوانية الأخرى مطلوبة، فإن الميزة والكفاءة الاقتصادية لإنزيم غراء النبات لا شك فيها.
مجالات تطبيق غراء متنوعة للغاية. في الطب، يتم استخدامه لعلاج الجروح، حيث يعزز تكسير البروتينات في الأنسجة التالفة وينظف سطح الجرح. غراء لا غنى عنه في علاج أمراض العيون المختلفة. إنه يسبب ارتشاف الهياكل الغائمة لجهاز الرؤية، مما يجعلها شفافة. التأثير الإيجابي للإنزيم في أمراض الجهاز الهضمي معروف. تم الحصول على نتائج جيدة عند استخدام الغراء لعلاج الأمراض الجلدية والحروق وكذلك في أمراض الأعصاب والمسالك البولية وغيرها من فروع الطب.
بالإضافة إلى الطب، يتم استخدام كميات كبيرة من هذا الإنزيم في صناعة النبيذ والتخمير. يزيد البابين من مدة صلاحية المشروبات. عند معالجتها بالغراء، يصبح اللحم طريًا وسهل الهضم بسرعة، وتزداد مدة صلاحية المنتجات بشكل كبير. الصوف المستخدم في صناعة النسيج لا يتجعد أو يتقلص بعد معالجته بالبابين. في الآونة الأخيرة، بدأ استخدام غراء في صناعة الدباغة. بعد المعالجة بالإنزيم، تصبح المنتجات الجلدية ناعمة ومرنة وأقوى وأكثر متانة.
وقد أدت الدراسة الدقيقة لبعض الأمراض المستعصية سابقاً إلى ضرورة إدخال الإنزيمات المفقودة إلى الجسم لتحل محل تلك التي ينخفض نشاطها. سيكون من الممكن إدخال الكمية المطلوبة من الإنزيمات المفقودة إلى الجسم أو "إضافة" جزيئات من تلك الإنزيمات التي قللت من نشاطها التحفيزي في العضو أو الأنسجة. لكن الجسم يتفاعل مع هذه الإنزيمات كما لو كانت بروتينات أجنبية، فيرفضها، وينتج أجسامًا مضادة ضدها، مما يؤدي في النهاية إلى التحلل السريع للبروتينات المدخلة. لن يكون هناك أي تأثير علاجي متوقع. كما أنه من المستحيل إدخال الإنزيمات مع الطعام، لأن العصارات الهضمية سوف "تهضمها" وتفقد نشاطها وتتحلل إلى أحماض أمينية دون أن تصل إلى الخلايا والأنسجة. يؤدي حقن الإنزيمات مباشرة في مجرى الدم إلى تدميرها بواسطة بروتياز الأنسجة. يمكن القضاء على هذه الصعوبات باستخدام الإنزيمات المثبتة. يعتمد مبدأ التثبيت على قدرة الإنزيمات على "الارتباط" بحامل مستقر ذو طبيعة عضوية أو غير عضوية. مثال على الارتباط الكيميائي للإنزيم بالمصفوفة (الحامل) هو تكوين روابط تساهمية قوية بين مجموعاتها الوظيفية. يمكن أن تكون المادة المصفوفة، على سبيل المثال، زجاجًا مساميًا يحتوي على مجموعات أمينية وظيفية يرتبط بها الإنزيم كيميائيًا.
عند استخدام الإنزيمات، غالبًا ما تكون هناك حاجة لمقارنة أنشطتها. كيف تعرف أي الإنزيم أكثر نشاطًا؟ كيفية حساب نشاط الأدوية النقية المختلفة؟ تم الاتفاق على أن نشاط الإنزيم يجب أن يؤخذ على أنه كمية الركيزة التي يمكنها في دقيقة واحدة تحويل 1 جرام من الأنسجة التي تحتوي على هذا الإنزيم عند درجة حرارة 25 درجة مئوية. كلما زاد عدد الركيزة التي يعالجها الإنزيم، كلما كان أكثر نشاطا. يتغير نشاط نفس الإنزيم حسب العمر والجنس والوقت من اليوم وحالة الجسم، ويعتمد أيضًا على الغدد الصماء التي تنتج الهرمونات.
لا ترتكب الطبيعة أي أخطاء تقريبًا، فهي تنتج نفس البروتينات طوال حياة الكائن الحي وتنقل هذه المعلومات الصارمة حول إنتاج نفس البروتينات من جيل إلى جيل. ومع ذلك، في بعض الأحيان يظهر بروتين متغير في الجسم، والذي يحتوي على واحد أو أكثر من الأحماض الأمينية "الإضافية"، أو على العكس من ذلك، يتم فقدانها. العديد من هذه الأخطاء الجزيئية معروفة الآن. لديهم أسباب مختلفة ويمكن أن تسبب تغيرات مؤلمة في الجسم. تسمى هذه الأمراض، التي تسببها جزيئات البروتين غير الطبيعية، بالأمراض الجزيئية في الطب. على سبيل المثال، يختلف الهيموجلوبين لدى الشخص السليم، والذي يتكون من سلسلتين متعدد الببتيد (a وb)، والهيموجلوبين لدى المريض المصاب بفقر الدم المنجلي (خلية الدم الحمراء على شكل منجل) فقط في المرضى الذين يعانون من يتم استبدال سلسلة ب، حمض الجلوتاميك بفالين. فقر الدم المنجلي هو مرض وراثي. تنتقل التغيرات في الهيموجلوبين من الآباء إلى الأبناء.
تسمى الأمراض التي تحدث عندما يتغير نشاط الإنزيم باعتلالات التخمر. وعادة ما تكون موروثة، وتنتقل من الآباء إلى الأبناء. على سبيل المثال، مع بيلة الفينيل كيتون الخلقية يتم تعطيل التحول التالي:
مع نقص إنزيم فينيل ألانين هيدروكسيلاز، لا يتحول الفينيل ألانين إلى تيروزين، بل يتراكم، مما يسبب اضطرابًا في الوظيفة الطبيعية لعدد من الأعضاء، وفي المقام الأول اضطراب في وظيفة الجهاز العصبي المركزي. يتطور المرض منذ الأيام الأولى من حياة الطفل، وبحلول ستة إلى سبعة أشهر من الحياة تظهر الأعراض الأولى. في دم وبول هؤلاء المرضى، يمكن العثور على كميات هائلة من الفينيل ألانين مقارنة بالمعدل الطبيعي. إن الكشف في الوقت المناسب عن مثل هذه الأمراض وتقليل تناول الأطعمة التي تحتوي على الكثير من الفينيل ألانين لهما تأثير علاجي إيجابي.
مثال آخر: غياب الإنزيم الذي يحول الجالاكتوز إلى جلوكوز عند الأطفال يؤدي إلى تراكم الجالاكتوز في الجسم، والذي يتراكم بكميات كبيرة في الأنسجة ويؤثر على الكبد والكليتين والعينين. إذا تم الكشف عن غياب الإنزيم في الوقت المناسب، يتم نقل الطفل إلى نظام غذائي لا يحتوي على الجالاكتوز. وهذا يؤدي إلى اختفاء علامات المرض.
بفضل وجود الاستعدادات الانزيمية، يتم فك بنية البروتينات والأحماض النووية. بدونها، فإن إنتاج المضادات الحيوية، وصناعة النبيذ، وخبز الخبز، وتوليف الفيتامينات أمر مستحيل. في الزراعة، يتم استخدام منشطات النمو التي تعمل على تنشيط العمليات الأنزيمية. العديد من الأدوية التي تثبط أو تنشط نشاط الإنزيم في الجسم لها نفس الخاصية.
بدون الإنزيمات، من المستحيل تخيل تطور مجالات واعدة مثل استنساخ العمليات الكيميائية التي تحدث في الخلية، وإنشاء التكنولوجيا الحيوية الصناعية الحديثة على هذا الأساس. حتى الآن، لا يمكن لأي مصنع كيميائي حديث أن ينافس ورقة نبات عادية، حيث يتم تصنيع خلاياها، بمشاركة الإنزيمات وأشعة الشمس، عدد كبير من المواد العضوية المعقدة المتنوعة من الماء وثاني أكسيد الكربون. وفي الوقت نفسه، يتم إطلاق كميات كبيرة من الأكسجين الضروري جدًا لحياتنا في الغلاف الجوي.
علم الإنزيمات هو علم شاب وواعد، منفصل عن البيولوجيا والكيمياء، ويعد بالعديد من الاكتشافات المذهلة لكل من يقرر أن يأخذه على محمل الجد.
تحميل الملخص: ليس لديك حق الوصول لتنزيل الملفات من خادمنا.